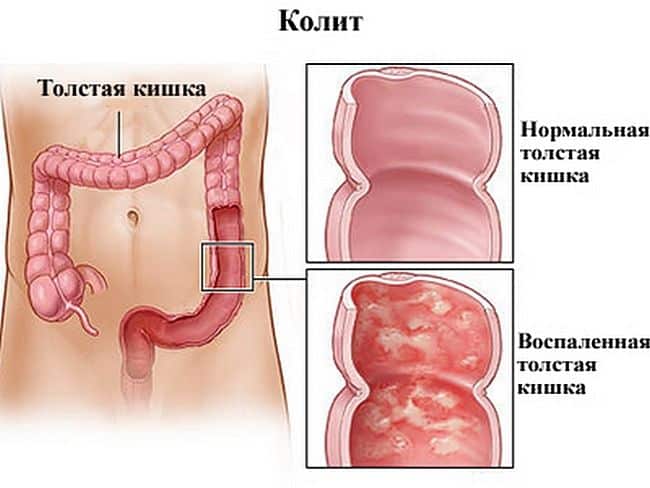
5 аск при колите

Лекарства с 5-АСК – это, пожалуй, одни из самых первых препаратов, которые назначаются больному с воспалительным заболеванием кишечника. В независимости от участка поражения, 5-аминосалициловая кислота является обязательной частью терапии НЯК и БК: зачастую, люди вынуждены принимать ее на протяжении всей жизни, дабы как можно дольше находиться в ремиссии.
Что такое 5-АСК, как она действует на пораженные участки слизистой, какие препараты являются наиболее популярными на сегодняшний день?
Пожалуй, стоит начать с небольшого ликбеза о том, что же такое 5-АСК и с чем его едят.
5-АСК (5-Аминосалициловая кислота) – это Месалазин, основа базисной терапии неспецифического язвенного колита и болезни Крона. Препараты 5-АСК увеличивают местную концентрацию простагландинов, оказывающих цитопротективное действие (повышение защитных возможностей слизистой оболочки кишечника). Впоследствии метаболизируется в организме, образуя N-ацетил-5-аминосалициловую кислоту. Сразу рекомендую к ознакомлению запись о ценах на Месалазин.
Виды препаратов с Месалазином
Для купирования симптомов НЯК используются два вида препаратов с 5-АСК:
- Сульфасалазин – довольно старый препарат, используемый в лечении НЯК уже более полувека. Основной недостаток— разнообразные побочные эффекты, от тошноты до головной боли. “Побочки” проявляются примерно в четверти случаев. Негативный эффект объясняется воздействием сульфапиридина, инертного вещества, служащего для доставки 5-АСК в толстую кишку. Сам сульфапиридин никак не задействован в затягивании язв. К наиболее распространенным из побочных действий Сульфасалазина относятся нарушение работы ЖКТ, крапивница, эритема, зуд, головная боль, лихорадка. В тяжелых случаях – нефротический синдром, нейропатия, агранулоцитоз, лекарственный гепатит, фиброзирующий альвеолит, анафилактический шок. При длительном лечении Сульфасалазином необходим лабораторный контроль крови, так как на фоне его приема часто возникает геморрагическая анемия, сдвиг лейкоцитарной формулы влево с появлением молодых форм лейкоцитов, лейкопения, тромбоцитопения, в моче – протеинурия, гематурия.
- Препараты с 5-АСК в более чистом виде — современная разработка, основанием для которой послужила высокая частота возникновения побочных эффектов от приема Сульфасалазина. Сейчас больным чаще всего назначают именно их. Чистый Месалазин дает сравнительно мало побочных эффектов, его рекомендуют даже детям, а также беременным и кормящим женщинам.
Если вы принимаете Сульфасалазин, следующая информация для вас: это лекарство блокирует конъюгацию фолиевой кислоты в щеточной кайме тощей кишки, замедляет ее транспортировку и угнетает активность связанных с ней ферментов в печени. Поэтому, для устранения возможного дефицита в фолиевой кислоте, необходимо принимать ее отдельно в качестве одноименной добавки.
Почему же сейчас существует такое большое разнообразие препаратов, в основе которых лежит эта самая 5-АСК, ведь суть их сводится к одному – заживить язвы в вашем ТК? Все дело в оболочке, в которую запаковано действующее вещество.
Выбор лекарств с 5-АСК
В разных частях нашего ЖКТ разная pH (кислотно-щелочная среда), под воздействием которой та самая оболочка растворяется, высвобождая 5-АСК наружу. Именно уровень pH и является причиной создания столь широкого спектра однотипных препаратов. Исключение составляет вышеупомянутый Сульфасалазин – оболочка этих таблеток растворяется под воздействием кишечной флоры.
Помимо таблетированного вида, 5-АСК выпускается в виде гранул, ректальных свечей и в жидкой форме (микроклизмы, пена), опять же, для воздействия на необходимые части ТК.
Наиболее популярные из препаратов с чистым Месалазином:
- Кансалазин.
- Салофальк.
- Пентаса.
- Мезавант.
- Месакол.
- Роваза.
- Асакол.
- Месакол.
В зависимости от части поражения толстого кишечника, имеет смысл применять соответствующий препарат с Месалазином. Приведу примеры:
- Поражена прямая кишка – свечи Салофальк/пена Салофальк.
- Поражены слепая кишка и восходящий отдел толстого кишечника – Асакол/Месакол/Кансалазин/таблетки Пентаса.
- Поражены нисходящий отдел, сигмовидный и прямая кишка – гранулы Салофальк/таблетки Пентаса/Мезавант/Месакол и пена Салофальк.
- Поражен весь толстый кишечник – таблетки Салофальк/Мезавант/Пентаса/Месакол.
По мере продвижения по толстому кишечнику уровень pH меняется. В зависимости от оболочки, в которую заключена 5-АСК, от 60% до 90% действующего вещества будет долго находиться в нисходящем, сигмовидном и прямом отделах толстого кишечника, где скорость всасывания препарата ниже.
Особое внимание стоит обратить на факт высвобождения Месалазина из своей оболочки. Если в стуле вы видите не растворившуюся таблетку, значит препарат вам точно не подходит, т.к. ваша кислотная среда не в силах расщепить оболочку. В таком случае, ни в коем разе не стоит разламывать таблетку и затем уже ее проглатывать: во-первых, Месалазин не дойдет до вашего толстого кишечника, а во-вторых можно просто сделать хуже другим системам вашего желудочно-кишечного тракта. Необходимо просто найти препарат, который вам подойдет. Благо, выбора предостаточно.
Исключением из этого правила являются гранулы Салофальк: несмотря на то, что после дефекации больные могут видеть некоторое количество “целых” гранул, это считается нормой.
Необходимо правильно рассчитывать необходимую дозировку применяемых препаратов 5-АСК. Для индукции ремиссии рекомендуется принимать от 3 до 4 гр Месалазина сверху (перорально) и (в случае проктита или проктосигмоидита) снизу (ректально).
Как правило, в связи с тем, что препараты 5-АКС необходимо принимать и во время ремиссии, у многих возникает дозозависимый эффект. Он проявляется в невозможности снова достичь ремиссии после обострения путем применения того же объема активного вещества, которого хватало в прошлый раз для индукции положительного состояния.
На своем опыте могу сказать, что для меня препаратом выбора оказался Мезавант, и он остается таковым вот уже на протяжении почти трех лет. А какие лекарства с 5-АСК сейчас принимаете Вы?
Источник
Возможности цитопротекции у больных неспецифическим язвенным колитом (месалазинами)
(таблицы дополнительно) https://novosti.mif-ua.com/archive/is…article-10594/
А.Э. Дорофеев, Донецкий национальный медицинский университет им. М. ГорькогоГастроэнтерология 2009 Клинические исследования
Воспалительные заболевания кишечника, в частности неспецифический язвенный колит (НЯК), являются серьезной медико-социальной проблемой [1, 6, 10, 11]. Сложность и многогранность патогенеза НЯК, гетерогенность возникающих иммунных и метаболических сдвигов предопределяют необходимость включения в терапевтический комплекс больных НЯК противовоспалительной терапии [4, 5, 13]. Эффективность препаратов, входящих в базисную терапию НЯК, оценивается по уменьшению или устранению развившихся воспалительных, цитокиновых, иммунных и морфологических нарушений [7, 9]. При этом исчезновение этих изменений свидетельствует о ликвидации острого воспаления в кишечнике, индукции ремиссии НЯК. Прогнозирование стабильности ремиссии в большей степени может быть связано с цитопротективными эффектами лекарственных препаратов, нормализацией слизистого барьера толстой кишки. Состояние слизистого барьера толстого кишечника определяется функциональными изменениями слизистой оболочки толстой кишки, свойствами толстокишечной слизи, количественным и качественным составом кишечной микрофлоры [2, 3, 12]. Цитопротективное воздействие базисной терапии НЯК, влияния на слизистый толстокишечный барьер позволят не только оценить эффективность ликвидации обострения, но и прогнозировать дальнейшее течение заболевания.
Одним из основных препаратов базисной терапии НЯК в настоящее время является месалазин, который блокирует липооксигеназный путь метаболизма арахидоновой кислоты и за счет этого обладает выраженной противовоспалительной активностью. Цитопротективное действие месалазина, его влияние на состояние слизистого барьера толстой кишки у больных НЯК изучено недостаточно.
Целью данной работы была оценка цитопротективного влияния месалазина на слизистый барьер толстого кишечника у больных НЯК.
Было обследовано 60 пациентов с левосторонним НЯК в стадии обострения, среди которых было 32 мужчины и 28 женщин. Средний возраст составлял 36,2 ± 4,2 года. Помимо общеклинических методов обследования всем больным НЯК было проведено повторное эндоскопическое исследование с биопсией слизистой оболочки толстой кишки и морфологическим исследованием биоптата. Фиксация биоптата слизистой толстой кишки проводилась в 4% растворе нейтрального формалина на одни сутки с последующей заливкой в парафин. Гистологические срезы толщиной 4–5 микрон производили на микротоме для парафиновых срезов. Срезы окрашивали гематоксилин-эозином, что позволило получить общие представления и оценить состояние исследуемой ткани. По этому препарату оценивали выраженность воспаления в слизистой оболочке толстой кишки, интенсивность и клеточный состав инфильтрата, количество и зрелость бокаловидных клеток [8]. Для характеристики слизеобразования проводилась PAS-реакция, с помощью которой выявляли гликопротеиды, гликолипиды и гликоген. При исследовании этих препаратов определяли количество PAS-положительных веществ в слизи и число активных лейкоцитов, содержащих гликоген в клеточном инфильтрате. Другие срезы окрашивали альциановым синим при значениях рН 1,0 и 2,5. При рН 1,0 сульфатные группы углеводов приобретают достаточный заряд для связывания положительно заряженных молекул красителя. При рН 2,5 окрашивали как сульфатные, так и карбоксильные группы углеводов, которые входят в состав сиаловых, глюкуроновой и индуроновой кислот. С помощью этой методики определяли сульфатированные и несульфатированные гликозаминогликаны, протеогликаны, гликопротеины и гликоген [3, 8]. Проводилась также лектинная гистохимия с использованием меченых пероксидазой лектинов. Применялись следующие лектины: завязей пшеницы WGA-тропного к N-ацетилглюкозамину, N-ацетилнейраминовой кислоте (сиаловой кислоте) (NANA), арахиса PNA-тропного к β-D-галактозе (β-DGal), бобовника анагиралистного LAL-тропного к α-L-фукозе (α–LFuc), омелы белой ML-1-тропного к α-L-галактозе (α-DGal), сои SBA-тропного к α-N-ацетилгалактозамину (α-DGalNAc), D-галактозе, семян чечевицы LCA-тропного к α-D-маннозе (α-DMan), D-глю-
козе, N-ацетилглюкозамину, виноград-ной улитки HPA-тропного к α-N-ацетил-глюкозамину (α-GlcNAc), бузины чер-ной SNA-тропного к D-галактозамину (α-GalNAc). Лектинная гистохимия по чувствительности и селективности в выявлении определенных молекулярных структур значительно превосходит традиционные методы гистохимии углеводов, что позволяет использовать этот метод в определении отдельных олиго- и дисахаридов при расшифровке состава муцинов. Кроме того, по ней можно оценивать количество специфических рецепторов не только в эпителиальных клетках, но и в строме. Состояние рецепторного аппарата колоноцитов во многом предопределяет возможности колонизации микрофлоры толстой кишки, ее жизнедеятельность и состав [3, 8].
В динамике изучали состояние микрофлоры толстой кишки, определяли количественный и качественный состав облигатной и факультативной флоры. Забор кала проводился утром в стерильную посуду и в течение 45 минут доставлялся в микробиологическую лабораторию. Определяли количество бифидобактерий, лактобацилл, кишечной палочки с исследованием ее ферментативных свойств, изучали количественный и качественный состав факультативной флоры с исследованием количества стафилококков и их ферментативных свойств, стрепто- и энтерококков, клостридий, клебсиелл, протея, энтеробактера, цитобактера, грибов рода Candida.
Все обследованные в качестве базисной терапии получали месалазин в дозе 4,0 г в сутки в течение 28 дней. Эндоскопические, морфологические и микробиологические исследования проводились у больных НЯК до начала терапии и после ее окончания.
Результаты. Клиника НЯК была типичной и характеризовалась нарушениями стула: поносами до 20 раз в день с примесью крови и слизи, тенезмами, ночными дефекациями, вздутиями кишечника, болевым, астеноневротическим синдромами. Среди обследованных у 36 (60,0 %) выявлено среднетяжелое течение НЯК, а у 24 (40,0 %) диагностировано легкое течение НЯК. Для оценки динамики состояния больных и определения эффективности проводимой терапии у пациентов определяли активность заболевания по индексу клинической активности. Индекс высчитывали в баллах [10]. У обследованных больных НЯК он составил 10,54 ± 0,91 балла. При эндоскопическом исследовании у всех больных НЯК до терапии выявляли гиперемию слизистой оболочки толстой кишки с изменением сосудистого рисунка, отечность слизистой толстой кишки с «зернистостью» — грануляциями мембранной поверхности слизистой оболочки, рассеивающими отраженный свет. Эрозии или язвы, повышенная ранимость слизистой оболочки толстой кишки, примеси слизи, фибрина, гноя обнаружены практически у всех пациентов, и степень выраженности этих изменений коррелировала со степенью тяжести НЯК.
Для объективизации динамической оценки эндоскопических изменений слизистой оболочки толстой кишки у больных НЯК было проведено определение эндоскопического индекса, который включал наличие грануляций мембранной поверхности слизистой оболочки, рассеивающих отраженный свет, изменений сосудистого рисунка, ранимость и контактную кровоточивость, поражения слизистой оболочки (эрозии, язвы, фибрин, слизь) и высчитывался в баллах [13]. Эндоскопический индекс в целом по группе больных НЯК до терапии составил 7,2 ± 0,7 балла.
До лечения у всех обследуемых выявлено снижение числа бокаловидных клеток, но степень их уменьшения коррелировала с тяжестью НЯК и варьировала от незначительного уменьшения количества бокаловидных клеток с преобладанием клеток с мелкими, незрелыми вакуолями у больных НЯК при легкой степени до выраженного снижения и иногда полного отсутствия бокаловидных клеток у пациентов со среднетяжелым течением НЯК. Установлено истончение, дистрофия поверхностного эпителия с перестройкой крипт, кроме того, у всех больных обнаружены дефекты поверхностного эпителия — от микроэрозий до глубоких язв, заполненных некротическими массами. На этом фоне у всех пациентов выявлена усиленная воспалительная клеточная инфильтрация слизистой оболочки толстой кишки, интенсивность которой колебалась от умеренной до выраженной.
В воспалительном клеточном инфильтрате у больных НЯК чаще преобладали лимфоциты — у 48 (80,0 %) больных, плазмоциты — у 36 (60,0 %), макрофаги — у 28 (46,7 %) пациентов. Нейтрофилы обнаруживались в инфильтрате у 36 (60,0 %) больных НЯК, при этом активные сегменто*ядерные лейкоциты, содержащие гликоген, обнаружены у 26 (43,3 %) обследуемых. Более чем у половины больных НЯК выявлялись внутриэпителиальные лимфоциты, что может быть маркером активности процесса.
Помимо изменений клеточного состава слизистой оболочки толстой кишки у больных НЯК выявлены нарушения слизеобразования. У всех обнаружено уменьшение количества внутриклеточной и внеклеточной слизи с изменением ее свойств. При проведении PAS-реакции, окрашивания альциановым синим рН 2,5 и рН 1,0, лектинами интенсивность окрашивания у всех больных НЯК была ниже нормы (P < 0,01), что свидетельствует об изменениях состава толстокишечной слизи, уменьшении в ней гликозаминогликанов и гликопротеинов. Количество N-ацетилнейраминовой кислоты, сиаловых кислот (окраска WGA) у больных левосторонним НЯК было снижено. При снижении общего количества галактозы (окраска PNA и ML-1) выявлялись модификации ее изомеров. Если количество b-D-галактозы по мере роста степени тяжести НЯК достоверно снижалось (окраска PNA), то уровень a-D-галактозы (окраска ML-1) у больных с различной степенью тяжести НЯК достоверно не отличался. Количество галактозамина и фукозы (окраска SBA SNA и LAL) было достоверно снижено у всех обследованных. Отмечался минимальный уровень маннозы (окраска LCA) у пациентов с левосторонним НЯК средней тяжести, а у больных с легким течением НЯК снижался незначительно. В то же время уровни глюкозы и глюкозамина (окраска HPA) существенно не изменялись у больных с различной степенью тяжести НЯК.
На фоне изменения количества толстокишечной слизи, ее свойств отмечено нарушение микробного пейзажа толстой кишки у больных НЯК до терапии. Патогенные микроорганизмы не были выделены ни у одного пациента, а облигатная флора — бифидобактерии, лактобациллы и кишечная палочка — высевалась почти у всех больных (96,7; 96,7; 100,0% соответственно). В целом по группе больных НЯК бифидобактерии и лактобациллы высевались реже, чем у здоровых, при этом их количество и удельный вес были достоверно снижены. У обследованных с НЯК при снижении количества кишечной палочки отмечалось повышение ее удельного веса (20,5 ± 2,0 % у больных НЯК и 16,6 ± 1,8 % у здоровых (P < 0,05)), а также модификация ее ферментативных свойств с увеличением количества штаммов со сниженной ферментативной активностью и гемолизирующих форм E.coli. Энтерококки, которые высевались у всех здоровых людей, выделены лишь у 26 (43,3 %) больных НЯК (P < 0,01). Чаще всего высевались энтерококки видов E.faecalis, E.aerogenes. Количество и удельный вес энтерококков в общей бактериальной популяции достоверно не изменялись. Снижение количества облигатной флоры приводило к понижению колонизационной резистентности и росту факультативных бактерий. Энтеробактер у пациентов с НЯК высевался достоверно чаще, чем у здоровых (40,08 и 24,00 % соответственно, P < 0,01), при этом его количество и удельный вес также достоверно превышали показатели здоровых лиц. Наиболее часто высевались E.agglomerans, E.gergoviae, E.sakazaki. Частота встречаемости стафилококков у больных НЯК была несколько выше, чем у здоровых, однако их количество и удельный вес у пациентов с НЯК достоверно не отличались. У больных НЯК, как и у здоровых лиц, чаще высевались S.epidermidis, S.aureus. Клебсиеллы высевались достоверно чаще у больных НЯК — 28 (46,7 %) пациентов, при этом их количество возрастало почти в 3,5 раза, а удельный вес — в 9,8 раза. Чаще всего у обследуемых с НЯК встречались K.oxyboca, K.pneumoniae. Частота высеваемости протея у больных НЯК была выше, чем у здоровых лиц, в 2,3 раза. Протей был выделен у 22 (36,7 %) пациентов с НЯК. Его количество было выше, чем у здоровых лиц, в 5,25 раза и составляло 2,52 ± 0,22 lg КОЕ/г при норме 0,48 ± 0,19 lg КОЕ/г (P < 0,001), при этом его удельный вес превышал норму в
14,5 раза (P < 0,001). Чаще у пациентов с НЯК высевался протей рода P.mirabilis. Количество цитобактера у больных НЯК достоверно превышало нормальные показатели (2,28 ± 0,22 lg КОЕ/г и 1,79 ± 0,32 lg КОЕ/г соответственно (P < 0,05)), а удельный вес был в 22 раза выше, чем у здоровых лиц (P < 0,0001). Грибы вида кандида у обследуемых с НЯК высевались с той же частотой, что и у здоровых лиц, а их количество и удельный вес соответствовали нормальным показателям.
Таким образом, у больных НЯК развивается дисбактериоз, который характеризуется снижением частоты встречаемости, количества и удельного веса облигатной флоры и увеличением факультативных бактерий. Дисбактериоз на фоне нарушения метаболизма клеток кишечного эпителия, изменения синтеза слизи и ее химизма способствует повышению проницаемости слизистого барьера толстой кишки, что приводит к усилению воспаления, развитию более распространенного процесса в толстом кишечнике и может способствовать формированию внекишечных проявлений.
На фоне терапии состояние больных достоверно улучшалось. На фоне 28-дневного лечения положительная клиническая динамика с улучшением самочувствия и уменьшением клинической симптоматики отмечена у всех больных НЯК. В то же время клиническая ремиссия НЯК выявлена у 54 (90,0 %) пациентов, а эндоскопическая — у 50 (83,3 %). На 16,9 ± 2,1 сут. у больных НЯК отмечено исчезновение болевого синдрома, тенезмов, ночного стула. В то же время нормализация частоты стула, исчезновение примеси крови и слизи в кале, вздутия и урчания кишечника наблюдались только у пациентов на фоне достижения полной клинической ремиссии. В целом по группе больных НЯК после терапии индекс клинической активности составил 2,89 ± 0,31 балла, а эндоскопический индекс был 2,3 ± 0,3 балла, что может свидетельствовать о достаточно высокой эффективности проводимой терапии.
На фоне положительной клинической динамики у обследованных с НЯК отмечена тенденция к нормализации микробного пейзажа толстой кишки (табл. 1). На фоне терапии повышалось общее количество кишечной палочки, при этом уменьшалось количество кишечной палочки со сниженными ферментативными свойствами и гемолизирующих штаммов Е.coli. Число бифидобактерий и лактобацилл на фоне терапии достоверно не менялось. В то же время после лечения у больных НЯК отмечена тенденция к уменьшению количества факультативной флоры. При использовании месалазина выявлено достоверное снижение количества энтеробактера, протея и цитобактера (P < 0,05).
Следовательно, на фоне применения базисной терапии НЯК с включением месалазина отмечается тенденция к нормализации микробного пейзажа толстой кишки с увеличением количества кишечной палочки, с нормализацией ее ферментативных свойств, уменьшением количества энтеробактера, протея, цитобактера. Возможно, это связано с улучшением метаболизма слизистой оболочки толстого кишечника и тенденцией к нормализации слизеобразования в толстой кишке.
После лечения у всех пациентов выявлена положительная гистологическая динамика, которая выражалась в снижении интенсивности клеточной инфильтрации слизистой оболочки толстой кишки. Гистологическая ремиссия выявлена у 48 (80,0 %) больных НЯК. Следует отметить, что у 12 (20,0 %) обследованных с НЯК, у которых выявлялись сегментоядерные лейкоциты в клеточном инфильтрате до лечения, эти клетки обнаруживались и после терапии. В то же время после лечения сегментоядерные лейкоциты, обнаруживаемые в слизистой оболочке толстой кишки, не содержали гликоген, что свидетельствует об отсутствии местной воспалительной активности. После лечения число бокаловидных клеток увеличивалось, они содержали более зрелую слизь. У 20 (33,3 %) больных НЯК выявлялось нормальное количество бокаловидных клеток, содержащих зрелую слизь. Почти у всех больных выявлено повышение интенсивности окрашивания при проведении PAS-реакции и методики с альциановым синим, особенно при pH 2,5. Это свидетельствует о нормализации процессов слизеобразования и нормальном соотношении сульфатированных и несульфатированных гликозаминогликанов в кишечной слизи.
Количество отдельных моносахаридов слизи у больных после терапии повышалось (табл. 2). Количество галактозы (окраска PNA и ML-1), уровень глюкозы и глюкозамина (окраска HPA) достоверно возрастали, но уровень галактозамина, фукозы, маннозы слизи (окраска SNA, LAL, LCA) увеличивался недостоверно. Полной нормализации слизеобразования у больных НЯК не наблюдалось, поэтому им было рекомендовано продолжить прием месалазина для поддержания ремиссии. Улучшение слизеобразования на фоне применения месалазина у больных НЯК способствовало более стабильной и длительной ремиссии. Если у пациентов, не принимавших поддерживающую дозу препарата, ремиссия длилась 9,2 ± 1,1 месяца, то у больных, получавших месалазин в ремиссии, продолжительность ее составляла 14,1 ± 1,4 месяца (P < 0,05).
Таким образом, применение месалазина является эффективным у больных НЯК. Его использование оказывает не только выраженный противовоспалительный, но и цитопротективный эффект, приводит к нормализации процессов слизеобразования, стимулирует продукцию слизи, способствует ее созреванию, что, возможно, обусловливает нормализацию количества и ферментативных свойств кишечной палочки и тенденцию к уменьшению количества факультативной флоры. Это способствует более стабильной и длительной ремиссии НЯК у таких больных.
Литература
1. Адлер Г. Болезнь Крона и язвенный колит. — М.: Геотар-Мед., 2001. — 500 с.2. Ардатская М.Д. Дисбактериоз кишечника // Materia Medica. — 2003. — № 2–3. — С. 16.
3. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. — М.: Триада-Х, 1998. — 496 с.
4. Белоусова Е.А. Язвенный колит и болезнь Крона. — Тверь: ООО «Издательство «Триада», 2002. — 128 с.
5. Халиф И.Л., Лоранская И.Д. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона): клиника, диагностика и лечение. — М.: Миклош, 2004. — 88 с.
6. Григорьева Г.А., Мешалкина Н.Ю. Болезнь Крона. — М.: ОАО «Издательство «Медицина», 2007. — 184 с.
7. Избранные главы клинической гастроэнтерологии: Сб. трудов / Под ред. Л.Б. Лазебника. — М.: Анахарсис, 2005. — 464 с.
8. Капуллер Л.Л., Маринушкин Т.Л., Костенко Н.В. Морфологические особенности раковых опухолей, возникающих на фоне хронического неспецифического язвенного колита // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2003. — № 4. — С. 58-64.
9. Парфенов А.И. Энтерология. — М.: Триада-Х, 2002. — 744 с.
10. Харченко Н.В., Бабак О.Я. Гастроентерологія. — К., 2007. — 720 с.
11. Hanauer S.B. Inflammatory bowel disease: epidemiology, pathogenesis and therapeutic opportunities // Inflam. Bowel. Dis. — 2006. — Vol. 12. — P. 3-9.
12. Rogler G. The effects of NOD2/CARD15 mutation on the function the intestinal barrier // J. of Crohn’s & Colitis. — 2007. — Vol. 1(2). — P. 53-60.
13. Sartor R.B., Sandborn W.J. Kirsner’s Inflammatory Bowel Disease. — London: Saundrs, 2004. — 6th ed. — 754 p.
Источник