Аланиновый цикл и цикл кори
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия, организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза.
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый.
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани.
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
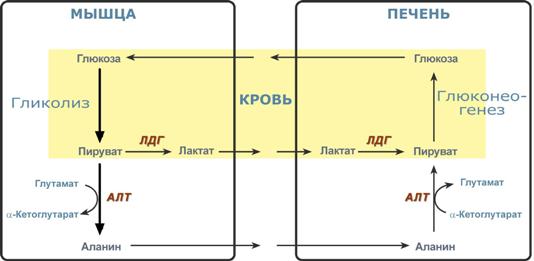
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставкааминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом и полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой аминного (аминокислотного) азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа через глутамат передается на синтез мочевины, пируват используется для синтеза глюкозы.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда белки мышц и других тканей распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Источник
Глюкоза
+ 2 АДФ + 2 H3PO4 =
2 Лактат + 2 АТФ + 2 Н2О
В
анаэробном гликолизе АТФ образуется
только за счет субстратного фосфорилирования
(2
моль АТФ на 1моль глюкозы).
Значение
анаэробного гликолиза особенно велико
для скелетных мышц. В интенсивно
работающих скелетных мышцах мощность
механизма транспорта кислорода
оказывается недостаточной для обеспечения
энергетической потребности, в этих
условиях резко усиливается анаэробный
гликолиз, и в мышцах накапливается
молочная кислота. Особое значение
анаэробный гликолиз имеет при
кратковременной интенсивной работе.
Так, бег в течение 30 с полностью
обеспечивается анаэробным гликолизом.
Однако уже через 4-5 мин бега энергия
поставляется поровну анаэробным и
аэробным процессами, а через 30 мин —
почти целиком аэробным процессом. При
длительной работе в аэробном процессе
используется не глюкоза, а жирные
кислоты.
Эритроциты
вообще не имеют митохондрий, поэтому
их потребность в АТФ удовлетворяется
только за счет анаэробного гликолиза.
Интенсивный гликолиз характерен также
для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и глюкозо-аланиновый цикл.
Молочная
кислота не является конечным продуктом
обмена, но ее образование — тупиковый
путь метаболизма: ее дальнейшее
использование связано опять с превращением
в пируват. Из клеток, в которых происходит
гликолиз, образующаяся молочная кислота
поступает в кровь и улавливается в
основном печенью, где и превращается в
пируват. Пируват в печени частично
окисляется, а частично превращается в
глюкозу. Часть пирувата в мышцах путем
трансаминирования превращается в
аланин, который транспортируется в
печень, и здесь снова образует пируват.
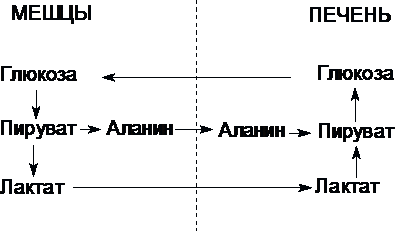
Рис.
Цикл Кори и глюкозо-аланиновый цикл
Биосинтез глюкозы (глюконеогенез).
Глюконеогенез
протекает в основном по тому же пути,
что и гликолиз, но в обратном направлении.
Однако три реакции гликолиза необратимы,
и на этих стадиях реакции глюконеогенеза
отличаются от реакций гликолиза.
Обходные пути глюконеогенеза.
I.
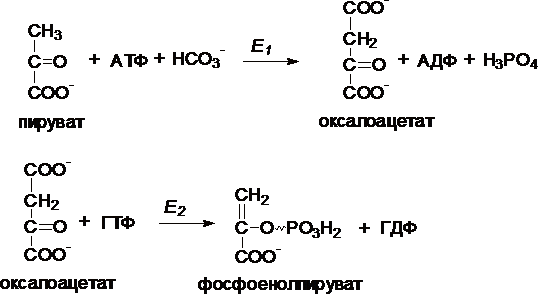
Первый обходной путь — превращение
пирувата в фосфоенолпируват.
Это
превращение осуществляется под действием
двух ферментов — пируваткарбоксилазы
(Е1) и карбокикиназы
фосфоенолпирувата (Е2).
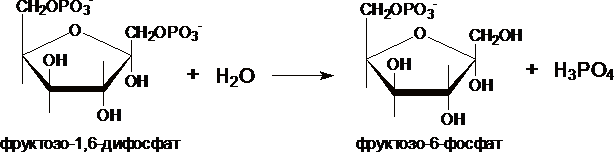
II. Превращение
фруктозо-1,6-дифосфата во
фруктозо-6-фосфат катализирует
фермент фруктозо-1,6-дифосфатаза.
III. Образование
глюкозы из глюкозо-6-фосфата катализирует
фермент глюкозо-6-фосфотаза .
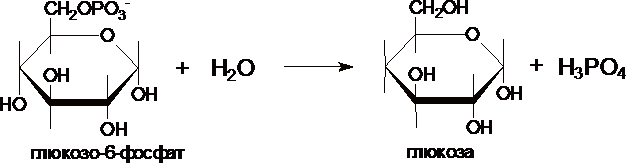
Этот
фермент отсутствует в клетках мозга,
скелетных мышц и др. тканях, поэтому
глюконеогенез, протекающий в этих тканях
не может поставлять глюкозу в кровь.
Глюкозо-6-фосфатаза локализована в
почках и, особенно, в печени, и
глюкозо-6-фосфат может превращаться в
глюкозу, если ее уровень в крови снижен.
Пентозофосфатный путь (пфп). Значение пфп.
Большая
часть глюкозы расщепляется по
гликолитическому пути. Наряду с гликолизом
существуют второстепенные пути
катаболизма глюкозы, одним из которых
является пентозофосфатный путь (ПФП).
Пентозофосфатный путь скорее даже —
анаболический путь, который использует
6 атомов С глюкозы для синтеза пентоз и
восстановительных эквивалентов в виде
НАДФН, необходимых для образования
липидов в организме. Однако, этот путь
— окисление глюкозы, и при определенных
условиях может завершиться полным
окислением глюкозы до СО2 и
Н2О.
Главные функции этого цикла следующие:
Генерирование
восстановительных эквивалентов в виде
НАДФН для восстановительных реакций
биосинтеза. Ферменты, которые катализируют
реакции восстановления, часто используют
в качестве кофактора НАДФ+/НАДФН,
а окислительные ферменты — НАД+/НАДН.
Восстановительные реакции биосинтеза
жирных кислот и стероидных гормонов
требуют НАДФН, поэтому клетки печени,
жировой ткани и др., где протекает синтез
липидов, имеют высокий уровень ферментов
ПФП. В печени около 30% глюкозы подвергаются
превращениям в
ПФП.
НАДФН
используется при обезвреживании лекарств
и чужеродных веществ в монооксигеназной
цепи окисления в печени.
НАДФН
предохраняет ненасыщенные жирные
кислоты эритроцитарной мембраны от
аномальных взаимодействий с активным
кислородом. Кроме того, эритроциты
используют реакции ПФП для генерирования
больших количеств НАДФН, который
необходим для восстановления глутатиона,
участвующего в системе обезвреживания
активного кислорода, что позволяет
поддерживать нормальную степень
окисления Fe2+ в
гемоглобине.
Снабжение
клеток рибозо-5-фосфатом для синтеза
нуклеотидов, нуклеотидных коферментов
и нуклеиновых кислот. Превращение
рибонуклеотидов в дезоксирибонуклеотиды
также требует НАДФН, поэтому многие
быстро пролиферирующие клетки требуют
больших количеств НАДФН.
Хотя
это не значительная функция ПФП, он
принимает участие в метаболизме пищевых
пентоз, входящих в состав нуклеиновых
кислот пищи и может превращать их
углеродный скелет в интермедиаты
гликолиза и глюконеогенеза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
22.05.20158.12 Mб165Биохимия — краткий курс.pdf
- #
22.05.201515.29 Mб106Биохимия витаминов (с кафедры).djvu
- #
- #
- #
- #
- #
- #
- #
22.05.201511.34 Mб27Вазопатии. Геморрагический васкулит.Лейкозы Ч2.pdf
- #
- #
Источник
Глюкозо-лактатный цикл (цикл Кори) – это связь глюконеогенеза в печени и образования лактата эритроцитах или мышцах из глюкозы. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах накопление лактата является следствием гликолиза при очень интенсивной, максимальной мощности, работе, и чем более такая работа интенсивна, тем менее продолжительна После нагрузки (во время восстановления) лактат удаляется из мышцы довольно быстро – всего за 0,5-1,5 часа.
Дополнение
Следует отметить, что если продолжительность нагрузки мала (до 10 секунд), то количество АТФ пополняется преимущественно в креатинфосфокиназной реакции. В таком режиме к примеру работают мышцы у штангистов, прыгунов как в длину, так и в высоту, метателей молота, копья и т.п.. Если нагрузка не более 90 секунд – АТФ синтезируется в основном в реакциях анаэробного гликолиза. В спорте это бегуны-спринтеры на 100-500 м, спортсмены силовых видов (борцы, тяжелоатлеты, бодибилдеры). Если напряжение мышцы длится более двух минут – развивается аэробное окисление глюкозы в реакциях ЦТК и дыхательной цепи.
Но, хотя мы и говорим об аэробном окислении глюкозы, необходимо знать и помнить, что лактат образуется в мышце всегда: и при анаэробной, и при аэробной работе, однако в разных количествах.
Образовавшийся лактат может утилизоваться только одним способом – превратиться в пировиноградную кислоту. Но, как уже указывалось, пируват токсичен для клеток и должен быть как можно быстрее утилизован. Сама мышца ни при работе, ни во время отдыха не занимается превращением лактата в пируват из-за наличия специфического изофермента ЛДГ-5.
Если молочная кислота поступила в миокардиоциты, она быстро превращается в пируват, далее в ацетил-S-КоА и вовлекается в полное окисление до СОB2B и НB2BО.
Большая часть лактата захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза.
Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты рансаминируются с a-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой и пирувата и азота из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы
Глюкоза, образованная в печени из лактата или аланина, возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена.
Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Регуляция гликолиза и глюконеогенеза
Дата добавления: 2014-02-03; просмотров: 13886; Опубликованный материал нарушает авторские права? | Защита персональных данных | ЗАКАЗАТЬ РАБОТУ
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Только сон приблежает студента к концу лекции. А чужой храп его отдаляет. 9147 — | 7763 — или читать все…
Читайте также:
Источник
Глюкозо-лактатный цикл (цикл Кори) – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани. В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии. В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата. Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы- 5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5- 1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой. Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза. Глюкоза, образованная в печени используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Г люкозо-аланиновый цикл. Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы. Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
люкозо-аланиновый цикл. Целью глюкозо-аланинового цикла также является уборка пирувата, но, кроме этого решается еще одна немаловажная задача – уборка лишнего азота из мышцы. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, оксалоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты трансаминируются с α-кетоглутаратом. Полученный глутамат взаимодействует с пируватом. Образующийся аланин является транспортной формой азота и пирувата из мышцы в печень. В гепатоците идет обратная реакция трансаминирования, аминогруппа передается на синтез мочевины, пируват используется для синтеза глюкозы. Кроме мышечной работы, глюкозо-аланиновый цикл активируется во время голодания, когда мышечные белки распадаются и многие аминокислоты используются в качестве источника энергии, а их азот необходимо доставить в печень.
Глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из АК. Все АК, кроме кетогенных лейцина и лизина, способны участвовать в синтезе глюкозы. Углеродные атомы некоторых из них – глюкогенных – полностью включаются в молекулу глюкозы, некоторых – смешанных – частично. Кроме получения глюкозы, глюконеогенез обеспечивает и уборку «шлаков» – лактата, постоянно образуемого в эритроцитах или при мышечной работе, и глицерола, являющегося продуктом липолиза в жировой ткани. Как известно, в гликолизе существуют три необратимые реакции: пируваткиназная (десятая), фосфофруктокиназная (третья) и гексокиназная (первая). В этих реакциях происходит высвобождение энергии для синтеза АТФ. Поэтому в обратном процессе возникают энергетические барьеры, которые клетка обходит с помощью дополнительных реакций. Глюконеогенез включает все обратимые реакции гликолиза, и особые обходные пути, т.е. он не полностью повторяет реакции окисления глюкозы. Его реакции способны идти во всех тканях, кроме последней глюкозо-6-фосфатазной реакции, которая идет только в печени и почках. Поэтому, строго говоря, глюконеогенез идет только в этих двух органах.
О бход десятой реакции гликолиза. На этом этапе глюконеогенеза работают два ключевых фермента – в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа. В химическом плане обходной путь десятой реакции выглядит достаточно просто:
бход десятой реакции гликолиза. На этом этапе глюконеогенеза работают два ключевых фермента – в митохондриях пируваткарбоксилаза и в цитозоле фосфоенолпируват-карбоксикиназа. В химическом плане обходной путь десятой реакции выглядит достаточно просто:
О днако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа – в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК. Поэтому в реальности все выглядит более сложно: 1. В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминирования аланина. После этого пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняюшей) реакцией ЦТК.
днако дело в том, что пируваткарбоксилаза находится в митохондрии, а фосфоенолпируват-карбоксикиназа – в цитозоле. Дополняет проблему непроницаемость митохондриальной мембраны для оксалоацетата. Зато через мембрану может пройти малат, предшественник оксалоацетата по ЦТК. Поэтому в реальности все выглядит более сложно: 1. В цитозоле пировиноградная кислота может появиться при окислении молочной кислоты и в реакции трансаминирования аланина. После этого пируват симпортом с ионами Н+, движущимися по протонному градиенту, проникает в митохондрии. В митохондриях пируваткарбоксилаза превращает пировиноградную кислоту в оксалоацетат. Эта реакция идет в клетке постоянно, являясь анаплеротической (пополняюшей) реакцией ЦТК.
2. Далее оксалоацетат мог бы превратиться в фосфоенолпируват, но для этого сначала он должен попасть в цитозоль. Поэтому происходит реакция восстановления оксалоацетата в малат при участии малатдегидрогеназы.В результате малат накапливается, выходит в цитозоль и здесь превращается обратно в оксалоацетат. Повернуть малатдегидрогеназную реакцию ЦТК вспять позволяет избыток НАДН в митохондриях. НАДН поступает из ?- окисления жирных кислот, активируемого в условиях недостаточности глюкозы в гепатоците.
3. В цитоплазме фосфоенолпируват-карбоксикиназа осуществляет превращение оксалоацетата в фосфоенолпируват, для реакции требуется энергия ГТФ. От молекулы отщепляется тот же углерод, что и присоединяется.
О![]() бход третьей реакции гликолиза. Второе препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-фосфат.
бход третьей реакции гликолиза. Второе препятствие на пути синтеза глюкозы – фосфофруктокиназная реакция – преодолевается с помощью фермента фруктозо-1,6-дифосфатазы. Этот фермент есть в почках, печени, поперечно-полосатых мышцах. Таким образом, эти ткани способны синтезировать фруктозо-6-фосфат и глюкозо-6-фосфат.
О бход первой реакции гликолиза. Последняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.
бход первой реакции гликолиза. Последняя реакция катализируется глюкозо-6-фосфатазой. Она имеется только в печени и почках, следовательно, только эти ткани могут продуцировать свободную глюкозу.
Глюконеогенез, как образование глюкозы из неуглеводных компонентов, необходим: 1. при гипогликемии во время мышечной нагрузки – синтез из молочной кислоты, поступающей из мышц, из глицерола, образующегося при мобилизации жиров;
2. при гипогликемии при голодании – синтез из аминокислот, образующихся при катаболизме белков.
Т аким образом, при голодании или физической нагрузке глюконеогенез, идущий в печени, обеспечивает глюкозой все остальные органы (эритроциты, нервная ткань, мышцы и др.), в которых активен гликолиз и другие процессы, производящие энергию. Наличие глюкозы в указанных клетках необходимо, чтобы поддержать концентрацию оксалоацетата и обеспечить сгорание ацетил-SКоА (получаемого также из жирных кислот или кетоновых тел) в цикле трикарбоновых кислот.
аким образом, при голодании или физической нагрузке глюконеогенез, идущий в печени, обеспечивает глюкозой все остальные органы (эритроциты, нервная ткань, мышцы и др.), в которых активен гликолиз и другие процессы, производящие энергию. Наличие глюкозы в указанных клетках необходимо, чтобы поддержать концентрацию оксалоацетата и обеспечить сгорание ацетил-SКоА (получаемого также из жирных кислот или кетоновых тел) в цикле трикарбоновых кислот.
Регуляция глюконеогенеза. Гормональная активация глюконеогенеза осуществляется глюкокортикоидами, которые увеличивают синтез пируваткарбоксилазы, фосфоенолпируват-карбоксикиназы, фруктозо-1,6-дифосфатазы. Глюкагон стимулирует те же самые ферменты через аденилатциклазный механизм путем фосфорилирования. Также имеется метаболическая регуляция, при которой аллостерически активируется пируваткарбоксилаза при помощи ацетил-SКоА, фруктозо-1,6-дифосфатаз а при участии АТФ. Переключение печени с гликолиза на глюконеогенез и обратно происходит с участием инсулина и глюкозагона и осуществляется с помощью:
— аллостерической регуляции активности ферментов;
-ковалентной модификации ферментов путём фосфорилирования/дефосфорилирования;
-индукции/репрессии синтеза ключевых ферментов.
Регуляторные воздействия направлены на ферменты, катализирующие необратимые стадии глюконеогенеза, сочетание которых называют «субстратными», или «холостыми» циклами.
Суммарное уравнение глюконеогенеза из пирувата:
2 пируват + 4 ATФ + 2 GTP + 2(NADH) + 4 Н2О Глюкоза + 4 ADP + 2 GDP + 2 NAD+ + 6 Н3РО4.
За сутки в организме человека может синтезироваться до 80 г глюкозы. На синтез 1 моль глюкозы из пирувата расходуется 6 макроэргических связей (4 ATФ и 2 GTP).
19. Пентозофосфатный путь превращения глюкозы. Окислительный путь образования пентоз. Представление о неокислительном пути образования гексоз. Распространение, роль, регуляция.
Глюкоза – это субстрат для получения энергии. Энергетика любой клетки нашего организма основана на окислении глюкозы. Окисление глюкозы происходит по двум направлениям:
1.Окисление с образованием пентоз: рибозы, рибулозы, ксилулозы. Этот путь называется пентозофосфатный шунт и не связан с получением Е.
2. Окисление с получением Е.
Так как в кл непрерывно просходят реакции синтеза белков, то для этого процесса требуются рибонуклеиновые кислоты. В свою очередь для синтеза самих нуклеиновых кислот, а точнее пуриновых и пиримидиновых нуклеотидов, требуется рибозо-5-фосфат. Если клетка готовится к делению, то для синтеза ДНК ей нужны дезоксирибонуклеотиды, которые образуются при участии НАДФН. Молекулы НАДФН также используются:
-для синтеза жирных к-т (печень, жировая ткань),
-для синтеза холестерола и др стероидов (печень),
-для синтеза глутаминовой к-ты из α-кетоглутаровой к-ты (реакция восстановительного аминирования),
-для систем антиоксидантной защиты клетки от свободно-радикального окисления (эритроциты).
В клетке существует процесс, обеспечивающий одновременное образование рибозы и НАДФН – это пентозофосфатный путь. Наиболее активно реакции пентозофосфатного пути идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, в гораздо меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока. Пентозофосфатный путь включает два этапа – окислительный и структурных перестроек (неокислительный).
клетке существует процесс, обеспечивающий одновременное образование рибозы и НАДФН – это пентозофосфатный путь. Наиболее активно реакции пентозофосфатного пути идут в цитозоле клеток печени, жировой ткани, эритроцитах, коре надпочечников, молочной железе при лактации, в гораздо меньшей степени в скелетных мышцах. Этот путь окисления глюкозы не связан с образованием энергии, а обеспечивает анаболизм клеток. В связи с этим у новорожденных и детей первых лет жизни его активность довольно высока. Пентозофосфатный путь включает два этапа – окислительный и структурных перестроек (неокислительный).
На первом, окислительном, этапе глюкозо-6-фосфат в трех реакциях превращается в рибулозо-5-фосфат, реакции сопровождаются восстановлением двух молекул НАДФ до НАДФН.
Н а этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы.
а этом этапе происходит регуляция процесса: инсулин повышает активность глюкозо-6-фосфат-дегидрогеназы и фосфоглюконат-дегидрогеназы.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования. Суммарное уравнение: Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного пути протекают только в том случае, если восстановленный ко-фермент NADPH возвращается в исходное окисленное состояние NADP+ при участии NADPH-зависимых дегидрогеназ. Если потребности клетки в NADPH незначительны, рибо-зо-5-фосфат образуется в результате обратимых реакций неокислительного этапа пентозофосфатного пути, используя в качестве исходных в-в метаболиты гликолиза — глицеральдегид-3-фосфат и фруктозо-6-фосфат.
Роль: Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм О2.
Второй этап – этап структурных перестроек, благодаря которым пентозы способны возвращаться в фонд гексоз. В этих реакциях рибулозо-5-фосфат изомеризуется до рибозо-5-фосфата и ксилулозо-5-фосфата. Далее под влиянием ферментов транскетолазы и трансальдолазы происходят структурные перестройки с образованием других моносахаридов. При реализации всех реакций второго этапа пентозы превращаются во фруктозо-6-фосфат и глицеральдегидфосфат. Глицеральдегид-3-фосфат в зависимости от условий и вида клеток может либо «проваливаться» во 2-й этап гликолиза либо через диоксиацетонфосфат восстанавливаться до глицерол-3-фосфата и далее направляться в синтез фосфатидной кислоты и далее триацилглицеролов. При необходимости из него могут образоваться и гексозы.
Сумма: 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат → 2 Ксилулозо-5-фосфат + Рибозо-5-фосфат 2 Ксилулозо-5-фосфат → 2 Рибулозо-5-фосфат 2 Рибулозо-5-фосфат → 2 Рибозо-5-фосфат.
Т.о. неокислительный путь можно представить как процесс возвращения пентоз в фонд гексоз.
Особенности пентозофосфатного пути в разных клетках.
Если клетка нуждается в больших количествах НАДФН (например, синтез жирных кислот в печени или синтез холестерола), то активно будут идти как 1-й, так и 2-й этапы. Образованные фруктозо-6-фосфат и глицеральдегидфосфат в реакциях глюконеогенеза превратятся в глюкозо-6-фосфат, и цикл начнется вновь.
Если клетке нужны НАДФН и энергия АТФ (как в эритроците), то фруктозо-6-фосфат и глицеральдегидфосфат на выходе из 2-го этапа «провалятся» в гликолитические реакции.
Если клетка растет и делится, то ей необходимы НАДФН и рибозо-5-фосфат. В этом случае 2-й этап идти не будет, весь образуемый на 1-м этапе рибулозо-5-фосфат превратится в рибозо-5-фосфат, который используется для синтеза нуклеотидов. НАДФН будет расходоваться на синтез дезоксирибонуклеотидов.
Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным ко-ферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид-3-фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле.
Наиболее активно Пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
Из нарушений пентозофосфатного шунта наиболее часто встречается недостаточность первого фермента – глюкозо-6-фосфат-дегидрогеназы. Следствием ферментного дефекта является снижение синтеза НАДФН в клетке. Особенно существенно это влияет на эритроциты, в которых окислительный этап пентозофосфатного цикла является единственным источником НАДФН. з разнообразных функций НАДФН в данном случае имеет значение одна – участие в работе антиоксидантной системы.
Д анная система необходима для нейтрализации активных форм кислорода, постоянно образующихся в клетке. В частности, перекись водорода восстанавливается до воды с помощью глутатион-зависимой пероксидазы. Восстановление глутатиона в работоспособное состояние производит редуктаза при участии НАДФН, поставляемого пентозофосфатным шунтом.
анная система необходима для нейтрализации активных форм кислорода, постоянно образующихся в клетке. В частности, перекись водорода восстанавливается до воды с помощью глутатион-зависимой пероксидазы. Восстановление глутатиона в работоспособное состояние производит редуктаза при участии НАДФН, поставляемого пентозофосфатным шунтом.
20. Глюкоза крови: источники, регуляция гормонами. Гипо- и гипергликемия, причины. Сахарные нагрузки и сахарные кривые, значение в диагностике.
Результат регуляции метаболических путей превращения глюкозы — постоянство концентрации глюкозы в крови. У здорового человека на тощак концентрация глюкозы в артериальной крови в течение суток поддерживается на постоянном уровне 60-100 мг/дл (3,3-5,5 ммоль/л). После приёма углеводной пищи уровень глюкозы возрастает в течение примерно 1 ч до 150 мг/дл (алиментарная гипергликемия), а затем возвращается к нормальному уровню (примерно через 2 ч). При конц-ии глюкозы в крови 9-10 ммоль/л глюкоза начинает выводиться с мочой – глюкозурия. В норме глюкоза в моче не определяется. Более половины всей глюкозы (60%), поступающей из кишечника в воротную вену, поглощается печенью. Около 2/3 этого количества откладывается в печени в форме гликогена, остальная часть превращается в жиры и окисляется, обеспечивая синтез АТФ. Ускорение этих процессов инициируется повышением инсулинглюкагонового индекса. Другая часть глюкозы, поступающей из кишечника, попадает в общий кровоток. Примерно 2/3 этого количества поглощается мышцами и жировой тканью. Это обусловлено увеличением проницаемости мембран мышечных и жировых клеток для глюкозы под влиянием высокой концентрации инсулина. Глюкоза в мышцах откладывается в форме гликогена, а в жировых клетках превращается в жиры. Остальная часть глюкозы общего кровотока поглощается другими клетками (инсулинонезависимыми).
При голодании в течение первых суток исчерпываются запасы гликогена в организме, и в дальнейшем источником глюкозы служит только глюконеогенез (из лактата, глицерина и АК). Глюконеогенез при этом ускоряется, а гликолиз замедляется вследствие низкой концентрации инсулина и высокой концентрации глюкагона. Но, кроме того, через 1-2 сут существенно проявляется действие и другого механизма регуляции — индукции и репрессии синтеза некоторых ферментов: снижается кол-во гликолитических ферментов и, наоборот, повышается количество ферментов глюконеогенеза. Изменение синтеза ферментов также связано с влиянием инсулина и глюкагона. Начиная со второго дня голодания достигается максимальная скорость глюконеогенеза из аминокислот и глицерина. Скорость глюконеогенеза из лактата остаётся постоянной. В результате синтезируется около 100 г глюкозы ежесуточно, главным образом в печени. Следует отметить, что при голодании глюкоза не используется мышечными и жировыми клетками, поскольку в отсутствие инсулина не проникает в них и таким образом сберегается для снабжения мозга и других глюкозозависимых клеток. Как в период покоя, так и во время продолжительной физической работы сначала источником глюкозы для мышц служит гликоген, запасённый в самих мышцах, а затем глюкоза крови. Известно, что 100 г гликогена расходуется на бег примерно в течение 15 мин, а запасы гликогена в мышцах после приёма углеводной пищи могут составлять 200-300 г.
Источник

