Аутоиммунное заболевание язвенный колит
 Бактерии
БактерииКак мы с вами знаем, язвенный колит и болезнь Крона принято считать заболеваниями аутоиммунного характера. О чем это говорит? Это значит, что определенные органы желудочно-кишечного тракта получают органические повреждения вследствие неправильной работы собственной иммунной системы человека. Для купирования воспаления больные НЯК и БК вынуждены использовать разного рода лекарства, к коим относятся 5-АСК, иммунодепрессанты, гормоны, препараты генной инженерии и пр.
Но разве есть хоть какой-нибудь смысл просто гасить воспаление, даже не стараясь вылечить пациента? Ясно, что, благодаря вышеуказанным лекарствам, людям с ВЗК удается сохранить все свои внутренние органы если не в целости, то хотя бы в сохранности. Предлагаю вам сегодня окунуться в глубины вероятных первопричин аутоиммунных заболеваний, ибо знание истинной причины своего недуга и механизмов его воздействия на ваш организм – это ключ к выздоровлению.
Сегодня мы не будем лезть в геном, в какие-то отдельные бактерии и т.п.; об этом вы можете узнать из статей, ссылки на которые находятся выше этих слов, в блоке “Смотрите также”. Итак, предлагаю вашему вниманию наиболее вероятные причины возникновения аутоиммунных заболеваний.
Дисбактериоз кишечника
Толстый кишечник – это примерно 80% нашего иммунитета. Очевидно, что какие бы то ни было сбои в его работе так или иначе отражаются на общем самочувствии человека.
Мы с вами знаем, что для нормальной работы кишечнику необходимы не только полезные бактерии, но и условно-патогенные, а также определенный их состав и пропорции. Кстати, подробнее о бактериях вы можете узнать из статей о дисбактериозе кишечника и БАД от Perfect Origins.
Так вот, нарушение микрофлоры в кишечнике ведет к повышенной проницаемости его стенок, что в итоге, во-первых, может вызвать пищевую аллергию.и, во-вторых, привести к не до конца переваренной пище. Не полностью переваренные элементы могут попадать в кровь, вызывая тем самым ответную реакцию со стороны иммунитета, а именно – попытку их ликвидировать.
Вероятно, именно вследствие ответа организма на такие элементы, может произойти сбой в работе иммунной системы.
Вирусы
Подробнее о вирусной природе НЯК и БК вы можете узнать из статьи про взаимосвязь ВЗК и ВЭБ (вирус Эпшейна-Барр). Здесь же я хочу сказать следующее.
Некоторые вирусы имеют свойство встраиваться буквально в каждую клетку нашего тела и провоцировать выработку иммунных тел, тем самым приводя к нарушениям в работе иммунной системы. Антитела пытаются вызволить клетки из жадных лап инфекции, а так как, считай, весь организм заражен, то и агрессия со стороны иммунитета должна быть весьма высокой.
К тяжелым металлам относятся более 40 химических элементов. Наиболее встречающимися из них в повседневности являются ртуть, медь, кадмий, золото, железо, свинец, таллий и висмут.
Мы готовим обработанную химикатами еду в алюминиевой посуде, пользуемся хлоркой во время уборки своего места жительства, дышим загрязненным воздухом… Представляете, какие процессы запускает в живом организме окружающая среда, если даже различные неорганические материалы под ее воздействием подвергаются коррозии?
Тяжелые металлы имеются свойство накапливаться, и их очень тяжело вывести из организма. Результат этой аккумуляции – снижение иммунитета, обострение хронических заболеваний и нарушение микрофлоры. Все это приводит к ухудшению самочувствия и повышенному риску развития заболеваний различных органов и систем, в числе которых ЦНС, кожные покровы, дыхательные пути, ЖКТ и др.
Касаемо желудочно-кишечного тракта, отравление тяжелыми металлами может характеризоваться как всеми знакомыми расстройствами стула (диарея и запоры), так и довольно специфичными признаками (появлением язв в ротовой полости, снижением аппетита и, как следствие, похудением). Рекомендую к ознакомлению статью о различиях НЯК и БК, дабы иметь понимание, к чему я тут про язвы написал.
Стресс
Стресс считается чуть ли не главной проблемой 21 века. “Все болезни от нервов” – слышали? Стресс приводит не только к очевидным изменениям в психоэмоциональном состоянии, но и вызывает нарушения в биохимических процессах организма. Не удивительно, что врачи и ученые относят хронический стресс к возможным первопричинам развития аутоиммунных заболеваний.
О вреде хронического стресса вы можете узнать из статьи “Влияние хронического стресса на прогрессирование НЯК и БК“.
Глютен
Многим больным НЯК, БК и другими аутоиммунными заболеваниями врачи советую придерживаться безглютеновой диеты даже при отсутствии у них аллергии на, собственно, глютен и вот почему.
Глютен (клейковина) провоцирует синтез зонулина – белка группы гаптоглобинов, вырабатываемых в печени и тканях внутреннего эпителия. Увеличенная концентрация зонулина в крови вызывает повышенную проницаемость стенок кишечника, что в итоге приводит к воспалению и активации иммунитета. Симптоматика воспалительного процесса может проявляться в виде тошноты, рвоты, нарушений стула и судорог внутренних органов. Абсорбция патогенных микроорганизмов и токсинов в ткани и кровоток приводит к увеличению проницаемости стенок кишечника и, как следствие, повышенной восприимчивости к различным возбудителям.
Как вы считаете, вследствие чего развилось именно ваше заболевание?
Источник
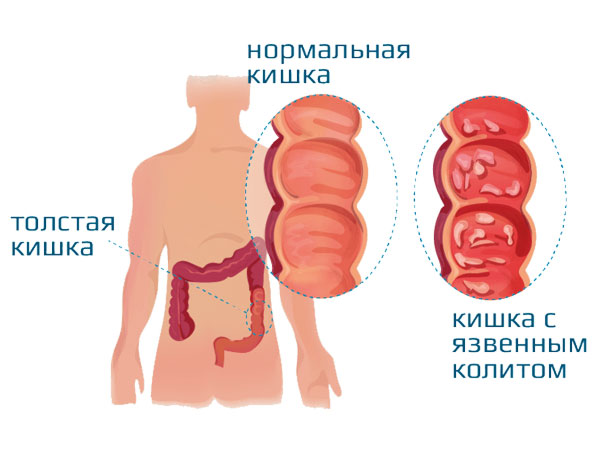
Неспецифический язвенный колит (НЯК) – хроническое аутоиммунное воспалительное заболевание толстой кишки. Наиболее часто при НЯК поражается прямая кишка и дистальный отдел толстой кишки. В тяжелых случаях возможно распространение процесса на проксимальные отделы толстой кишки с развитием панколита. Поражение кишки носит диффузный характер, проявляется отеком и гиперемией кишки, сглаживанием складок, формированием неправильной формы язв. Изъязвления могут затрагивать только слизистую оболочку кишки или носить трансмуральный характер, проникая в мышечный слой и серозную оболочку. На фоне язвенных дефектов формируются псевдополипы, представляющие собой остатки сохранившейся слизистой оболочки или участки ее гиперплазии, или полиповидные разрастания грануляционной ткани. В период ремиссии заболевания слизистая оболочка кишки частично восстанавливается. Вместе с тем сохраняется атрофия ее слизистого слоя, деформация крипт, неравномерное утолщение собственной пластинки.
С наибольшей частотой НЯК встречается в Европе и Северной Америке (40-120 больных на 100000 населения). Наиболее часто заболевают лица в возрасте 20-40 лет.
Иммунологические исследования свидетельствуют, что у больных НЯК в сыворотке крови и стенке кишки содержатся аутоантитела, способные реагировать с общим антигеном толстой кишки, и циркулирующие иммунные комплексы. По данным морфологических исследований, слизистая оболочка кишки обильно инфильтрирована лейкоцитами, гранулоцитами, моноцитами. Установлено, что аутоантитела и иммунокомпетентные клетки, инфильтрирующие кишку, индуцируют цитолиз эпителиоцитов ее слизистого слоя, генерируют в ней воспаление и дегенеративные процессы через продукцию провоспалительных цитокинов (ИЛ-1?, ИНФ-гамма, ФНО?, ИЛ-6), простагландинов, лейкотриенов и лизосомных ферментов. Аутоантитела и циркулирующие иммунные комплексы, фиксируясь на стенке капилляров и сосудах, изменяют их проницаемость, вызывают отек кишки. Активация системы комплемента и образование С3а и С5а, а также воспалительный процесс, развивающийся под влиянием аутоантител и ЦИК, выступают мощным дополнительным фактором (помимо антигенного) инфильтрации стенки кишки клеточными элементами, которые, как установлено, играют ведущую роль в развитии патологических процессов в ней. Полагают, что инфицирование кишки патогенными микробами является вторичным процессом и часто выступает фактором развития осложнений.
Для НЯК характерны три ведущих клинических симптома: наличие в кале слизи (ad oculus) и крови, нарушение моторно-эвакуаторной функции толстой кишки (диарея – 3-20 раз в сутки, реже – запоры, тенезмы), боль в животе (часто локализована в гипогастральной или левой подвздошной области, схваткообразная, усиливающаяся при дефекациях и уменьшающаяся или исчезающая после них).
К внекишечным проявлениям НЯК относят анемию, лихорадку, потерю аппетита, снижение массы тела, поражение опорно-двигательного аппарата (мигрирующий поли- или моноартрит крупных суставов, спондилит, изолированный сакроилеит), кожи (узловатая эритема, пиодермия), глаз (увеиты, кератит, конъюктивиты), печени (активный гепатит, склерозирующий холангит).
Характерным для иммунного статуса больных НЯК является повышение специфической цитотоксической активности Т-лимфоцитов, положительная реакция бласттрансформации лимфоцитов на общий антиген толстой кишки, РТМЛ, повышение концентрации в сыворотке крови IgМ, G, А и ЦИК, наличие аутоантител к антигену толстой кишки. Среди клеток,инфильтрирующих слизистую кишку, высокий процент занимают CD8+, CD16+- клетки и IgG- продуцирующие клетки.
Основу лекарственной терапии НЯК составляют азосоединения салициловой кислоты (месалазин), топические глюкокортикоидные препараты (будесонид), иммунодепрессанты (азатиоприн, меркаптопурин). Терапевтический эффект месалазина (основного препарата в лечении НЯК) связывают с его способностью тормозить синтез и высвобождение простагландинов и лейкотриенов, эффективно ингибировать продукцию провоспалительных цитокинов в слизистой оболочке кишечника и его антиоксидантными свойствами. Показано, что препарат подавляет аутоиммунные процессы в кишечнике.
Для лечения легких и средней тяжести форм язвенного колита месалазин (салофальк) назначают в суточной дозе 1,5-2 г, разделенной на 3-4 приема. При тяжелых формах дозу препарата увеличивают до 3,0-4,5 г в сутки. Высокие дозы салофалька, примененные в фазу обострения, практически эквивалентны по эффективности глюкокортикоидам. Высокие дозы салофалька не рекомендуется использовать более 8-12 недель.
Для лечения левосторонних форм НЯК используют салофальк в клизмах (по 2 г в 30 мл – при легких и среднетяжелых формах и по 4 г в 60 мл при тяжелых формах). Обычно клизмы делают ежедневно вечером перед сном.
Для профилактики рецидивов НЯК месалазин (салофальк) назначают в дозе 1,0-1,5 мг в сутки. Эффективно применение свечей салофалька.
Глюкокортикостероидные препараты рекомендуется назначать при отсутствии эффекта от препаратов группы месалазина. Пероральный прием преднизолона начинают с дозы 30-60 мг в сутки (от 2 недель до 1 месяца) с постепенным ее снижением до 5 мг/сутки и последующей отменой на фоне терапии месалазином.
Препараты глюкокортикоидов при тяжелых формах заболевания в 70% случаев позволяют добиться ремиссии, а в сочетании с препаратами месалазина – в 90% случаев. Для лечения легких и среднетяжелых форм НЯК рекомендуется назначать буденофальк (будесонид – топический кортикостероид), который обадает ярко выраженным местным противовоспалительным, антиаллергическим и антиэкссудативным действием. Механизм действия препарата, обусловливающий эти свойства, основан на уменьшении выделения медиаторов воспаления из активированных тучных клеток, базофилов, макрофагов, подавление миграции и концентрации клеток воспаления в слизистой оболочке кишки и мембраностабилизирующем действии. Буденофальк назначают по 3 мг 3 раза в сутки за 30 мин до еды. Длительность применения составляет обычно 8 недель. Применение будесонида в клизмах в дозах не менее, чем 2 мг (100 мл), является эффективным и безопасным способом лечения дистальных форм язвенного колита.
При неэффективности лечения НЯК месалазиновыми и глюкокортикоидными препаратами назначают иммуносупрессивные средства – азатиоприн, меркантопурин, метотрексат, циклоспорин А.
Азатиоприн (азафальк) применяется в суточной дозе 1,5-2,5 мг/кг массы тела, в тяжелых случаях – до 5 мг/кг/сутки. Терапевтический эффект наступает не ранее, чем через 3-4 месяца в 80% случаев. Циклоспорин А назначают обычно в дозе 4 мг/кг/сутки.
В качестве специфического цитокинового ингибитора рекомендуется назначение ремикейда (инфликсимаба). Основой препарата служат МАТ, специфически взаимодействующие с ФНО?. Для лечения НЯК также рекомендуется реаферон (1-2 млн. ед. 3 раза в неделю, не менее 3 месяцев), аллопурин (100 мг 3 раза в день, в качестве антиоксиданта), такролимус (как альтернативы циклоспорину А).
Терапия НЯК сопровождается адекватной диетой, антидиарейными средствами, противомикробными препаратами.
Источник
Аутоиммунный гастрит.
Аутоиммунный гастрит относится к частым аутоиммунным заболеваниям и наиболее частым аутоиммунным заболеванием желудочно-кишечного тракта (ЖКТ). Этому заболеванию в 30% случаев сопутствуют другие аутоиммунные патологические состояния: аутоиммунные заболевания щитовидной железы, алопеция и витилиго. Аутоиммунный гастрит протекает субклинически и редко является поводом обращения пациентов к врачу. В его основе лежит аутоиммунная реакция, направленная против обкладочных (париетальных) клеток желудка, а также против внутреннего фактора (фактора Кастла). Обкладочных клеток больше в теле желудка, поэтому обычно аутоиммунный гастрит проявляется атрофией фундальных отделов, по сравнению с антральным гастритом при инфекции Helicobacter pylori. Для деффиринцаильной диагностики гастрита, ассоциированного с аутоиммунной реакцией и связанного с инфекцией Helicobacter pylori, используется тест Серологическое обследование гастритов типов А и В. Обкладочные клетки желудка вырабатывают соляную кислоту и внутренний фактор Кастла, необходимый для всасывания витамина В12 в кишечнике. Уничтожение обкладочных клеток ведет к гипоацидному гастриту, мальабсорбции, железодефицитной и пернициозной анемиям.
Антитела к обкладочным (париетальным) клеткам желудка.
Париетальные (обкладочные) клетки желудка вырабатывают соляную кислоту и внутренний фактор Кастла, необходимый для всасывания витамина В12 (кобаламина) в кишечнике. Основным антигеном антител к париетальным клеткам желудка (АПКЖ) является бета-субъединица Н+/К+ АТФ-азы, мембрано-ассоциированного ионного насоса, который участвует в закислении содержимого желудка. Аутоантитела являются комплемент-фиксирующими и непосредственно участвуют в разрушении популяции обкладочных клеток и развитии атрофического гастрита. Не отмечается взаимосвязи между обнаружением аутоантител к париетальным клеткам желудка и антральным гастритом, основной этиологической причиной которого является инфекция Helicobacter pylori. Титры аутоантител не коррелируют с тяжестью атрофии слизистой желудка, поэтому их мониторинг не целесообразен. Антитела к обкладочным клеткам желудка отмечаются у 90% больных с атрофическим гастритом и пернициозной анемией. Другие проявления дефицита витамина В12, обусловленные аутоиммунным гастритом, включают полиневрит, фуникулярный миелоз, атаксию, истощение мышц и снижение рефлексов. Нарушение закисления желудка приводит также к нарушению всасывания железа в тонком кишечнике, поэтому аутоиммунный гастрит, связанный с присутствием аутоантител к парительным клеткам желудка, может также приводить к развитию железодефицитной анемии с характерной клиникой этого состояния. Макроцитарная анемия обусловлена дефицитом эритропоэза в связи с нехваткой витамина В12. Анемия развивается через несколько лет после развития аутоиммунного гастрита, поскольку в норме в печени человека сохраняется значительный запас витамина. Анемия проявляется увеличением среднего размера эритроцита, повышением цветного показателя, характерными изменениями нейтрофилов, низким количеством ретикулоцитов, тромбоцитопенией и лейкопенией. Кроме того отмечается мегалобластная трансформация в костном мозге.
Антитела к внутреннему фактору (фактору Кастла).
Внутренний фактор (фактор Кастла) представляет собой гликопротеин массой 72 кДа, который секретируется в просвет желудка и связывает и транспортирует в стенку кишки витамина В12 (кобаламина). Аутоантитела к внутреннему фактору способны вызывать нарушение его функции как за счет блокады его связывания с витамином, так и препятствуя адсорбции комплекса в тонком кишечнике. Антитела к внутреннему фактору являются более специфичными по сравнению с антителами к парительным клеткам желудка при диагностике пернициозной анемии и дефицита витамина В12, однако встречаются только у 60% больных с аутоиммунным гастритом.
Комплексная оценка аутоантител при подозрении на аутоиммунный гастрит позволяет повысить точность лабораторной диагностики данного состояния (Диагностика гастрита типа А и пернициозной анемии).
Диагностика воспалительный заболеваний кишечника (болезнь Крона и язвенный колит).
Болезнь Крона (БК) и язвенный колит (ЯК) представляют собой хронические, рецидивирующие, идиопатические расстройства ЖКТ. При этом БК характеризуется иммунным, трансмуральным, сегментарным, гранулематозным воспалением ЖКТ различной протяженности от полости рта до анального отверстия, с развитием местных и системных осложнений, а ЯК — поражением только толстой кишки с обязательным вовлечением прямой, и воспаление при этом чаще всего ограничивается слизистой оболочкой кишечника и носит диффузный характер. Болезнь Крона и язвенный колит представляют собой наиболее частые формы ВЗК в европейской популяции и за последние несколько лет наблюдается стабильное повышение заболеваемости и распространенности данных заболеваний в развитых и развивающихся странах (5,6 на 100,000 в год в некоторых странах Европы). По данным Американского центра по эпидемическому контролю болезней примерно 1,4 млн. человек популяции США страдают от воспалительных заболеваний кишечника. В Германии распростраенность оценивается в пределах 1/500 до 1/800 взрослого населения. В Санкт-Петербурге по данным городского центра ВЗК на учете стоит 5,500 пациентов. Диагноз БК и ЯК, согласно международным и отечественным клиническим рекомендациям по диагностике и лечению ВЗК, устанавливается на основании всесторонней оценки клинической картины заболеваний, данных эндоскопических, радиологических, гистологических и лабораторных методов исследований. В 2011 году были опубликованы данные, рекомендующие рутинное использование панелей серологических маркеров для диагностики или мониторинга ВЗК в клинической практике. Но аутоантитела при ВЗК имеют ограниченную диагностическую ценность в первичной диагностике вследствие их низкой чувствительности.
Серологические маркеры диагностики болезни Крона. Антитела к пекарским дрожжам Sacchаromyces cerevisiae и антитела к экзокринной части поджелудочной железы и антигену GP2.
Антитела к пекарским дрожжам Sacchаromyces cerevisiae (ASCA) являются основным лабораторным маркером болезни Крона. Кроме антител к антигенам пекарских дрожжей, при болезни Крона появляются антитела к другим комменсальным организмам ЖКТ. Так, при этом заболевании появляются антитела антигенам кишечной палочки, псевдомонад, а также антигенам полисахаридной стенки многих микроорганизмов. Основными иммуногенными эпитопами антител к сахаромицетам являются также компоненты полисахаридов, в том числе маннотетроза и маннотриоза.
Антитела к сахаромицетам выявляются при болезни Крона с частотой, составляющей около 50% (30-70%). Антитела могут быть представлены IgG или IgA, обладая общей специфичностью для диагностики болезни Крона составляющей 93%. Частота выявления ASCA не зависит от географического района и демографии обследованных групп, что указывает на универсальность иммунологического механизма, лежащего в основе иммунной реакции против клеток сахаромицет. Характерно, что антитела к сахаромицетам часто отмечаются у родственников больных воспалительными заболеваниями кишечника (20-25%). У клинически здоровых лиц ASCA могут быть выявлены у 1-3% лиц общей популяции. При болезни Крона антитела к сахаромицетам могут появляться до клинического дебюта заболевания. При болезни Крона у пациентов с ASCA заболевание течет тяжелее, что связано с частыми эпизодами кишечной непроходимости, кроме того заболевание лучше отвечает на терапию блокаторами фактора некроза опухоли-альфа. В то же время, титры антител не коррелируют с клинической активностью процесса. Антитела к сахаромицетам могут использоваться для дифференциальной диагностики болезни Крона и неспецифического язвенного колита, поскольку встречаемость антител у больных с язвенным колитом не превышает 10%. Редко ASCA встречаются при первичном билиарном циррозе, первичном склерозирующем холангите, целиакии. Отсуствие антител к сахаромицетам (ASCA) не исключает вероятности болезни Крона.
Антитела к центроацинарным клеткам реагируют с цитоплазмой ацинарных клеток поджелудочной железы или с глобулярными структурами в протоках поджелудочной железы. Причина появления антител к ацинарным клеткам при БК остается неизвестной. Поражение поджелудочной железы иногда отмечается при ВЗК, однако не обнаружено взаимосвязи между панкреатитом и появлением антител к панкреоцитам. Вероятно, это связано с преимущественной экскрецией большинства антигенов в составе сока поджелудочной железы. Описано несколько антигенов ацинарных клеток, в частности гликопротеин GP2, который экскретируются поджелудочной железой в просвет кишечника. Антитела к экзокринной части поджелудочной железы отмечаются у 10-20% пациентов с болезнью Крона, несколько чаще у сравнительно молодых пациентов. Крайне редко антитела к центроацинарным клеткам поджелудочной железы могут отмечаться при других заболеваниях ЖКТ. Обнаружение антител к экзокринной части поджелудочной железы указывает на высокую вероятность БК и требует углубленного клинического и инструментального обследования. В сочетании с другими клиническими, инструментальными и лабораторными находками выявление антител позволяет поставить диагноз БК.
Изучение антигенных мишеней антител к центроацинарным клеткам привело к описанию белка GP2 (гликопротеина 2 типа) который является основным антигеном экскреторных гранул зимогенов. Обладая высокой структурной гомологией с белком Тамм-Хорсфала в моче, гликопротеин GP2 в просвете кишечника выполняет антибактериальную функцию, связываясь с фимбриями бактерий. Кроме того гликопротеин GP2 обладает антиапоптотическим и пролиферативным действием на энтероциты, таким образом, выступая в качестве протективного фактора. Антитела к GP2 классов IgGи IgA отмечаются у 30-35% пациентов с болезнью Крона, независимо от присутствия ASCA, поэтому совместное использование обоих маркеров позволяет выявить серологические признаки заболевания у 60-70% пациентов. Антитела к GP2 чаще отмечаются у более молодых больных.При БК антитела к GP2 антигену отмечаются при илиоколите, стриктурирующей формах заболевания с частым перианальным воспалением. Антитела к GP2 редко отмечаются у больных с неспецифическим язвенным колитом и менее чем у 3% здоровых лиц. Антитела к GP2 могут отмечаться при других заболеваниях ЖКТ, в том числе целиакии.
Серологические маркеры диагностики язвенного колита. Антитела к цитоплазме нейтрофилов (АНЦА) IgA и Антитела к бокаловидным клеткам кишечника (БКК).
Антинейтрофильные цитоплазматические антитела (АНЦА) были впервые описаны при гранулематозных васкулитах. При системных васкулитах в качестве основных антигенов антинейтрофильных антител выступает ряд ферментов содержащихся в азурофильных гранулах нейтрофилов. К известным антигенным мишеням АНЦА относятся протеиназа-3, миелопероксидаза, лактоферрин, эластаза, белок BPI и катепсин G. Антинейтрофильные антитела также используются в качестве диагностических маркеров при воспалительных заболеваниях кишечника, однако при этих заболеваниях большинство антигены аутоантител плохо изучено. Метод непрямой иммунофлюоресценции остается «золотым стандартом» выявления антинейтрофильных антител, поскольку позволяет определить как частые антигены (такие как протеиназа-3 или миелопероксидаза), так и редкие мишени аутоантител, которые охарактеризованы недостаточно хорошо. Для клинической диагностики воспалительных заболеваний кишечника целесообразно дополнять выявление антинейтрофильных антитела класса IgA выявлением антинейтрофильных цитоплазматических антител класса IgG.
Антитела к цитоплазме нейтрофилов часто отмечаются при аутоиммунной патологии желудочно-кишечного тракта. Они встречаются при язвенном колите (70%), болезни Крона (2-7%), аутоиммунном гепатите (50%), первичном склерозирующем холангите (40%), первичном биллиарном циррозе (5%), болезни Шенлейн-Геноха (70%) и васкулитах при ревматоидном артрите (5-10%). При неспецифическом язвенном колите выявление высоких титров антинейтрофильных антител отмечается у больных с тяжелым течением заболевания. Повышенный титр АНЦА IgA указывает на вероятный диагноз язвенного колита и ассоциированного с ним первичного склерозирующего холангита.
Бокаловидные клетки кишечника (БКК) вырабатывают слизь, которая защищает слизистую кишки от агрессивных факторов содержимого кишки. Такие клетки, имеющие форму чаши (бокала), можно обнаружить во всех отделах кишечника, однако их число максимально в прямой кишке, особенно в криптах толстого кишечника. Основным антигеном БКК являются муцины – семейство гликопротеинов, состоящие из белка и углеводной последовательности. Как центральный белок, так и углеводная цепь являются мишенью антител при неспецифическом язвенном колите (НЯК).
Наличие антител к БКК тесно связано с язвенным колитом. Антитела к БКК часто отмечаются у пациентов с ЯК 15-40%, редко встречаются при болезни Крона, других орган-специфических аутоиммунных заболеваниях и очень редко у здоровых лиц. Также антитела к БКК могут встречаться при аутоиммунной энтеропатии – редком состоянии, связанном со снижением числа бокаловидных клеток, виллезной атрофией и воспалением в тонком кишечнике. Аутоиммунная энтеропатия проявляется рецидивирующией диареей, нарушением всасывания, кроме того она часто бывает связана с другими аутоиммунными заболеваниями и полиэндокинопатиями. Другим важным серологическим тестом на аутоиммунную энтеропатию является Определение антител к энтероцитам методом непрямой иммунофлюоресценции для диагностики аутоиммунной энтеропатии.
Источник