Дифференциальная диагностика язвенного колита
 Дифференциальный диагноз неспецифический язвенный колит (НЯК) достаточно сложен, так как целый ряд заболеваний имеет подобные клинические симптомы. Это прежде всего болезнь Крона, ишемический колит, полипоз, дивертикулез, рак толстой кишки, геморрой, дизентерия, амебиаз, балантидиаз, актиномикоз, туберкулезный и малярийный колиты, лимфогранулематоз, псевдомембранозный энтероколит.
Дифференциальный диагноз неспецифический язвенный колит (НЯК) достаточно сложен, так как целый ряд заболеваний имеет подобные клинические симптомы. Это прежде всего болезнь Крона, ишемический колит, полипоз, дивертикулез, рак толстой кишки, геморрой, дизентерия, амебиаз, балантидиаз, актиномикоз, туберкулезный и малярийный колиты, лимфогранулематоз, псевдомембранозный энтероколит.
Крона болезнь возникает чаще в илеоцекальной области. Заболевание развивается постепенно, острое начало наблюдается редко. Основные жалобы — на умеренные боли в животе, учащение стула до 4—6 раз в сутки, реже — запоры. Пальпаторно определяется инфильтрат в правой подвздошной области или на определенном участке по ходу ободочной кишки. При выраженном отеке развиваются симптомы кишечной непроходимости. Последние наблюдаются и при хроническом течении процесса, когда фиброзные изменения стенки кишки на уровне поражения ведут к сужению ее просвета.
Осложненные формы болезни характеризуются наличием внутренних и наружных свищей, поражением перианальной области. Рентгенологически отмечаются локальное сужение просвета, ригидность стенки, замедление пассажа бария. При ректороманоскопии и колоноскопии в зоне поражения просматриваются незначительный отек и гиперемия слизистой, иногда изолированные щелевидные язвы. Рецидивы заболевания часты, полной ремиссии, как правило, не бывает.
Ишемический колит является следствием нарушения кровоснабжения какого-либо участка ободочной кишки. Наблюдается у людей старше 50 лет с заболеваниями сердечнососудистой системы. При нестойкой ишемии единственным симптомом является боль в животе в течение 1—2 часов после приема пищи. При длительной ишемии болевой симптом более устойчив и сопровождается жидким стулом с примесью крови.
Наиболее важное значение для диагностики ишемического колита имеют данные ирригоскопии: поражение левого изгиба ободочной кишки, где отмечаются ригидность стенки, сглаженность гаустрации, дефекты наполнения вследствие подслизистых кровоизлияний.
Селективная ангиография позволяет выявить склерозированные или облитерированные сосуды, стенозы и окклюзии артерий и установить истинную причину патологии.
Диффузный полипоз, так же как неспецифический язвенный колит, проявляется выделением крови и слизи из прямой кишки. Однако наследственная предрасположенность, отставание в росте и общем развитии, анемия, пигментация слизистых, кожи лица, пальцы в виде барабанных палочек позволяют заподозрить синдром Пейтца — Егерса. Выявление полипов при пальцевом исследовании, ирригоскопии, ректороманоскопии или колоноскопии дает возможность поставить правильный диагноз, а данные биопсии уточняют природу полипоза.
При дивертикулезе ободочной кишки диарея и кишечное кровотечение наблюдаются редко. Чаще отмечаются неустойчивый стул, чувство неполного опорожнения кишечника. Характер кровотечения (алая кровь или “дегтеобразный” стул) определяется локализацией кровоточащего дивертикула.
Ирригоскопия методом двойного контрастирования является наиболее информативной при выявлении дивертикулов ободочной кишки. Эндоскопически просматривается наличие отверстий в стенке кишки выстланных слизистой оболочкой, и определяется кровотечение из дивертикула. Изъязвления слизистой оболочки, наблюдаемые при неспецифическом язвенном колите, при дивертикулезе обычно отсутствуют.
Рак ободочной кишки сопровождается слизисто-кровянистыми выделениями у 7—20 % больных, при значительных воспалительных изменениях появляется примесь гноя. В случае локализации опухоли в правой половине ободочной кишки наступают нарушения питания, общего состояния, анемия: макроскопически крови в кале может и не быть, но реакция Грегерсена обычно положительная. Опухоли левой половины чаще проявляются клиникой кишечной непроходимости; при этом на поверхности каловых масс нередко наблюдаются прожилки крови и слизи или каловые массы окрашены в темный цвет. Пальпируемая в ряде случаев опухоль, данные ирригоскопии и колоноскопии помогают в дифференциальной диагностике, а проведенная биопсия определяет характер роста.
Для геморроя не характерны признаки общей интоксикации и учащение стула. При пальцевом исследовании и ректороманоскопии выявляется расширение прямокишечных вен с кровотечением из геморроидальных узлов.
Бактериальную дизентерию с острым началом, тенезмами, стулом со слизью и кровью, лихорадкой трудно дифференцировать с неспецифическим язвенным колитом. Учет эпидемиологических факторов, меньшая выраженность токсемии, отсутствие контактной кровоточивости слизистой оболочки прямой кишки при ректоскопии и ранних возможных при НЯК осложнений, результативность лечения больных антибиотиками и сульфаниламидными препаратами помогают установить диагноз. Характерная эндоскопическая картина при отсутствии язв и псевдополипов, обычный диаметр просвета кишки позволяют думать о бактериальной природе процесса. Положительные данные бактериологического исследования на наличие дизентерийной палочки разрешают спорные вопросы диагностики.
Кишечный амебиаз в отличие от неспецифического язвенного колита развивается медленно; при нем длительное время отсутствуют явления интоксикации, анемия, истощение, не бывает значительных кровотечений и обильных гнойных выделений из кишечника.
При ректороманоскопии выявляются глубокие, редкие язвы различной величины и формы. Они имеют подрытые края, неровное сальное дно, вокруг узкую полоску гиперемии с точечными кровоизлияниями.
При ирригоскопии отмечается чередование пораженных сегментов с непораженными, отсутствуют псевдополипы, могут контурироваться дефекты наполнения, обусловленные образованием в стенке кишки амебных гранулем.
Затруднения в дифференциальной диагностике возникают при осложнении кишечного амебиаза вторичной инфекцией. Исследование кала больных, соскоба слизистой оболочки прямой кишки, выявляя типичные вегетативные формы гистологической амебы, помогает поставить правильный диагноз.
Балантидиаз (инфузорная дизентерия) в сравнении с неспецифическим язвенным колитом встречается очень редко. Для балантидиаза характерны крупные щелевидные язвы с неровными краями и белыми налетами, слизистая вокруг них обычно не изменена. Диагноз ставится на основании прогистологического исследования кала или соскоба из язвы, которое выявляет крупную, яйцевидной формы с ресничками инфузорию Ваlantidium coli.
При актиномикозе чаще поражается слепая и восходящий отдел ободочной кишки и реже — нисходящая кишка. Ирригоскопически устанавливается сужение просвета кишки, сдавливаемой извне инфильтратом. Наличие свищей облегчает диагностику.
Положительная кожная проба с актинолизатом, реакция связывания комплемента с актинолизатом в качестве антигена, нахождение друз подтверждают диагноз актиномикоза.
Туберкулезный язвенный колит может симулировать неспецифический язвенный колит, так как нередко сопровождается частым, жидким стулом с примесью слизи, крови и гноя.
Основными признаками различия являются: локализация процесса при туберкулезном поражении в слепой кишке, эндоскопически — язвы имеют подрытые края и серое с творожистым некрозом дно, характерен рассеянный тип поражения слизистой оболочки; рентгенологические симптомы зазубренности контуров, сужения и ригидности кишечной стенки выявляются, как правило, только на уровне слепой и восходящей кишки.
Туберкулез ободочной кишки чаще отмечается у больных, страдающих длительное время туберкулезным поражением других органов. Специфическое лечение достаточно эффективно.
Малярийный колит возникает в связи с обтурацией капилляров толстой кишки эритроцитами, содержащими плазмодии. Ишемия слизистой ведет к образованию язв, что проявляется поносами с кровью. Появление кровавой диареи обычно связано с приступом малярии. Обнаружение плазмодиев малярии в крови больных устанавливает истинную причину язвенного процесса в ободочной кишке.
Лимфогранулематоз ободочной кишки—трудное для диагностики заболевание. Жидкий стул, частые интестинальные кровотечения, возможность перфорации кишки — основные проявления этой патологии. Картина крови имеет свои особенности — нарастающий моноцитоз, значительная эозинофилия, увеличение тромбоцитов, ретикулоцитов и СОЭ. Диагноз определяется только после гистологического исследования.
Псевдомембранозный энтероколит — следствие дисбактериоза на фоне применения антибиотиков широкого спектра действия. Чаще наблюдается у пожилых и ослабленных больных. Некроз участков слизистой кишечника сопровождается болями в животе, профузными поносами, кишечным кровотечением, нередко признаками почечной недостаточности и коллаптоидным состоянием. В копрограммах, помимо крови, слизи и гноя, находят мембранозные пленки, представляющие собой отторгшиеся участки слизистой оболочки кишки. Бактериологические исследования, эндоскопия с биопсией помогают установить диагноз.
Оценить статью
Источник
Определение лабораторных маркеров воспалительных заболеваний кишечника (антитела к Sacchаromyces cerevisiae и антитела к цитоплазме нейтрофилов), используемое для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
Состав исследования:
- Антитела к цитоплазме нейтрофилов, IgG (с определением типа свечения)
- Антитела к Sacchаromyces cerevisiae (ASCA) классов IgA
- Антитела к цитоплазме нейтрофилов класса IgA (АНЦА)
Синонимы русские
Серологические тесты при болезни Крона и неспецифическом язвенном колите, антитела к Sacchаromyces cerevisiae и антитела к цитоплазме нейтрофилов (АНЦА).
Синонимы английские
Inflammatory Bowel Disease, Serology panel, Anti-Saccharomyces cerevisiae antibodies (ASCA, ASCAs) and Anti-neutrophil cytoplasmic antibodies (ANCA, ANCAs).
Метод исследования
Непрямая реакция иммунофлюоресценции.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Воспалительные заболевания кишечника (ВЗК) — группа состояний, при которых наблюдается нарушение иммунного ответа организма на антигены собственного кишечника и/или антигены нормальной микрофлоры собственного кишечника. В результате этого в кишечнике развивается и поддерживается воспалительный процесс. Выделяют две основные нозологические формы ВЗК: болезнь Крона (БК) и неспецифический язвенный колит (НЯК). Несмотря на некоторую общность патогенеза и принадлежность к одной группе болезней, НЯК и БК характеризуются разным прогнозом и разной тактикой лечения. Поэтому правильная дифференциальная диагностика двух болезней имеет принципиальное значение. Дифференциальная диагностика НЯК и БК носит комплексный характер, и, как правило, включает развернутое серологическое обследование. В настоящее время наиболее широко используются следующие маркеры:
- Антитела к цитоплазме нейтрофилов
Антитела к цитоплазме нейтрофилов (АНЦА) – это группа антител, направленных против различных компонентов нейтрофилов. Их определяют с помощью непрямой реакции иммунофлюоресценции (РНИФ). Кроме факта наличия АНЦА большое значение имеет тип свечения. Говоря о ВЗК, однако, важно различать «типичные» и «атипичные» АНЦА.
Различают два основных типа свечения АНЦА: цитоплазматический (в этом случае говорят о наличии ц-АНЦА, или c-ANCA) и перинуклеарный (п-АНЦА, или p-ANCA). Цитоплазматический тип характеризуется зернистым, диффузным окрашиванием цитоплазмы. Показано, что основным антигеном для ц-АНЦА является протеиназа-3. «Типичный» перинуклеарный тип характеризуется гомогенным, кольцевидным окрашиванием перинуклеарной цитоплазмы. Показано, что основным антигеном для п-АНЦА является миелопероксидаза. Таким образом, ц-АНЦА и типичные п-АНЦА взаимодействуют преимущественно с цитоплазматическими антигенами. Указанные типы АНЦА – это хорошо известные маркеры первичных васкулитов.
Существует также третий тип свечения АНЦА, называемый «атипичным» перинуклеарным типом. Этот тип характеризуется неоднородным, широким, кольцевидным свечением периферической части ядра с множественными внутриклеточными включениями. Таким образом, в отличие от ц-АНЦА и типичных п-АНЦА, атипичные п-АНЦА взаимодействуют преимущественно с ядерными, а не с цитоплазматическими антигенами. Какой-либо специфический антиген для атипичных п-АНЦА, однако, до сих пор не найден.
Следует помнить, что клиническое значение атипичных п-АНЦА отличается от типичных п-АНЦА. Говоря о п-АНЦА при ВЗК (особенно при НЯК), имеют в виду именно атипичные п-АНЦА (но не типичные п-АНЦА). Часто эти антитела путают.
Так как антиген для атипичных п-АНЦА не выявлен, РНИФ остается единственным способом их выявления. Для сравнения: после того как было установлено, что в большинстве случаев антигеном для типичных п-АНЦА является миелопероксидаза, были разработаны более точные тест-системы на основе иммуноферментного анализа (ИФА). Сегодня ИФА является обязательным подтверждающим тестом при выявлении типичных п-АНЦА. В случае же с атипичными п-АНЦА такого подтверждающего теста нет.
Атипичные п-АНЦА обнаруживаются в крови 40-80% пациентов с НЯК и 5-25% пациентов с БК. Эти антитела также могут быть выявлены при других видах колита (например, эозинофильном и коллагенозном колите), других аутоиммунных заболеваниях (например, при первичном склерозирующем холангите — до 88%, и аутоиммунном гепатите I типа — до 81%). У здоровых людей атипичные п-АНЦА встречаются редко (1-3%).
- Антитела к Sacchаromyces cerevisiae
Антитела к Sacchаromyces cerevisiae (ASCA) – антитела, направленные преимущественно против фосфопептидоманнана (компонента клеточной стенки, включающего маннозу) пекарских дрожжевых грибов Sacchаromyces cerevisiae. Манноза входит в состав не только пекарских дрожжевых грибов, но также и некоторых микобактерий и других микроорганизмов (например, дрожжеподобных Candida albicans). До сих пор патофизиологическая роль ASCA не до конца ясна.
Чаще ASCA обнаруживаются у пациентов с БК (50-80% случаев), чем у пациентов с НЯК (2-14%). Распространенность ASCA гораздо выше среди пациентов со спорадическими случаями БК и в семьях только с БК (63%), чем в семьях с БК и НЯК (около 33%).
По структуре ASCA относятся к иммуноглобулинам IgG и IgA классов. Приблизительно у 2/3 пациентов с БК и положительным результатом ASCA IgG также определяются ASCA IgA. До 20% пациентов с БК имеют только ASCA IgA, что объясняет необходимость исследовать оба класса антител.
ASCA также могут быть выявлены при других аутоиммунных заболеваниях (например, при аутоиммунном гепатите – до 20%, болезни Бехчета, первичном билиарном циррозе) и других заболеваниях кишечника (например, при целиакии). У здоровых людей ASCA встречаются редко (1-7%).
Из-за недостаточно высокой чувствительности и специфичности диагностическая роль отдельных тестов п-АНЦА и ASCA несколько ограничена. Большее значение имеет комбинация этих тестов. Результат ASCA+/атипичные п-АНЦА- более характерен для БК, в то время как результат ASCA-/атипичные п-АНЦА+ — для НЯК.
В нескольких исследованиях показано, что комбинация двух тестов позволяет различить НЯК и БК с чувствительностью 30-64% и специфичностью более 90%. Следует отметить, что отрицательный результат каждого теста в отдельности или в комбинации не позволяет полностью исключить ВЗК. Также наличие указанных антител в отдельности или в комбинации не позволяет со 100% уверенностью подтвердить диагноз ВЗК. Результат этого комплексного анализа оценивают с учетом всех значимых клинических, лабораторных и инструментальных исследований.
Для чего используется исследование?
- Для дифференциальной диагностики болезни Крона и неспецифического язвенного колита.
Когда назначается исследование?
- При наличии симптомов воспалительного заболевания кишечника (ВЗК): диареи с примесью крови или слизи/констипации, боли в области живота, тенезмов, тошноты и рвоты, потери веса, лихорадки, анемии;
- при обследовании пациента с отягощенным наследственным анамнезом по болезни Крона или неспецифическому язвенному колиту.
Что означают результаты?
Референсные значения
Антитела к цитоплазме нейтрофилов, IgG (с определением типа свечения)
Титр: менее 1:40.
Результат: не обнаружено.
Антитела к Sacchаromyces cerevisiae (ASCA) классов IgA
0 — 20 RU/ml.
Антитела к цитоплазме нейтрофилов класса IgA (АНЦА)
Положительный результат:
Атипичные п-АНЦА | ASCA |
Неспецифический язвенный колит Болезнь Крона Эозинофильный колит Коллагенозный колит Аутоиммунный гепатит Первичный склерозирующий холангит Здоровые люди (1-3%) | Болезнь Крона Неспецифический язвенный колит Аутоиммунный гепатит Болезнь Бехчета Первичный билиарный цирроз Целиакия Здоровые люди (1-7%) |
Характерная комбинация аутоантител при БК и НЯК:
Болезнь Крона | Неспецифический язвенный колит |
ASCA+/атипичные п-АНЦА- | ASCA-/атипичные п-АНЦА+ |
Отрицательный результат:
- норма.
Что может влиять на результат?
- ASCA чаще выявляются в спорадических случаях болезни Крона или в семьях только с БК и реже в семьях с БК и НЯК.
Важные замечания
- ASCA могут быть выявлены у 1-7% здоровых людей, атипичные п-АНЦА – у 1-3%;
- результат исследования следует оценивать с учетом анамнестических, лабораторных и инструментальных данных.
Также рекомендуется
[02-007] Скорость оседания эритроцитов (СОЭ)
[02-001] Анализ кала на скрытую кровь
[02-009] Копрограмма
[06-182] С-реактивный белок, количественно (метод с нормальной чувствительностью)
[13-071] Диагностика воспалительных заболеваний кишечника (антитела к бокаловидным клеткам кишечника и протокам поджелудочной железы)
Кто назначает исследование?
Гастроэнтеролог, врач общей практики, педиатр.
Литература
- Papp M, Norman GL, Altorjay I, Lakatos PL. Utility of serological markers in inflammatory bowel diseases: gadget or magic? World J Gastroenterol. 2007 Apr 14;13(14):2028-36.
- Iskandar HN, Ciorba MA. Biomarkers in inflammatory bowel disease: current practices and recent advances. Transl Res. 2012 Apr;159(4):313-25.
- Lewis JD. The utility of biomarkers in the diagnosis and therapy of inflammatory bowel disease. Gastroenterology. 2011 May;140(6):1817-1826.e2.
Источник
Лабораторные
данные:
Общий анализ крови:
признаки анемии, лейкоцитоз со сдвигом
влево, увеличение СОЭ.Общий анализ мочи:
протеинурия умеренная.БАК: гипопротеинемия,
снижение содержания альбуминов,
увеличение Y-глобулинов, трансаминаз,
серомукоида, сиаловых кислот, фибрина.
4. Анализ кала: эритроциты, лейкоциты,
слизь в большом количестве.
Инструментальные
исследования:
Ректороманоскопия
и колоноскопия: в прямой кишке и других
отделах толстой кишки обнаруживается
отечность, гиперемия, зернистость
слизистой оболочки, ее кровоточивость,
эрозии и язвы, нередко покрытые гнойными
налетами.Ирригоскопия
(производится при хронической форме
заболевания в фазе затихания обострения):
сужение просвета кишки на пораженном
участке. Отсутствие или неравномерность
гаустр, при наличии глубоких язв — депо
бария.
Программа
обследования:
Общий анализ крови,
мочи, кала, бактериологическое
исследование кала, в том числе на
дизентерию.БАК: белок и белковые
фракции, трансаминазы, билирубин,
сиаловые кислоты, фибрин, серомукоид.Ректороманоскопия.
Колоноскопия.
Ирригоскопия.
Дифференциальный
диагноз
Прежде
всего, необходимо провести дифференциальный
диагноз с острой
дизентерией. В
связи с необходимостью соблюдения
противоэпидемического режима нередко
больной до установления правильного
диагноза обследуется в инфекционном
отделении. Дизентерию исключают на
основании отрицательных посевов кала
и исследований крови на антигены
дизентерийных бактерий. Эндоскопическая
картина, свойственная язвенному колиту
(см. выше), не характерна для дизентерии,
при которой, как правило, имеются лишь
гиперемия, эрозии и геморрагии. Важно
также, что антибактериальная терапия,
дающая быстрый эффект при дизентерии,
при неспецифическим язвенным колитом
или неэффективна или ведет к прогрессированию
болезни.
Дифференциально-диагностические
трудности возникают при болезни
Крона с
локализацией в прямой и ободочной кишке.
При язвенном колите в отличие от
гранулематозного отсутствуют поражения
перианальной зоны (свищи, трещины),
воспалительный процесс в кишке начинается
со слизистой оболочки и с самого начала
сопровождается кровотечениями,
отсутствует рельеф типа «булыжной
мостовой», щелевидные язвы. При
гистологическом исследовании биопсийного
или операционного материала в подслиэистом
слое отсутствуют характерные для болезни
Крона типичные эпителиоидные гранулемы
с клетками Пирогова—Лангханса.
Исключительно
важное значение имеет дифференциальный
диагноз с эндофитно растущими опухолями
толстой кишки (рак,
лимфома), диффузным
семейным полипозом, в
распознавании которых решающее значение
имеют колонофиброскопия с множественной
повторной биопсией пораженных участков
кишки.
Для
ишемического поражения толстой кишки
характерны боль в левой половине живота,
запоры и выделения крови с калом.
Дифференциально-диагностическими
критериями могут служить сосудистый
шум над брюшным отделом аорты, отсутствие
симптомов интоксикации и диареи.
Консервативное
лечение НЯК основывается на следующих
принципах:
диетотерапия;
базисная терапия
препаратами 5-аминосалициловой кислоты
и/или глюкокортикоидами (системного и
местного действия);антибактериальные
средства;цитостатики
(иммунодепрессанты);иммуномодуляторы;
симптоматическая
(«сопровождающая») терапия.
Лечение
НЯК должно быть комплексным, обязательно
с тщательным соблюдением режима дня и
питания. Необходимы спокойные прогулки
на свежем воздухе. При значительном
нарушении общего состояния, лихорадке,
истощении, метаболических сдвигах и т.
д. режим должен быть постельным.
Лечение
В
последние годы выработаны новые стандарты
лечения НЯК благодаря введению строгих
критериев медицины, основанной на
доказательствах. В целом эти стандарты
базируются на результатах контролируемых
исследований, данных метаанализов,
однако в отношении некоторых препаратов
существуют еще рекомендации, которые
основаны лишь на нескольких контролируемых
или даже неконтролируемых исследованиях.
Эффективность лечения оценивается либо
по проценту ремиссии, либо как «Odds
ratio» (с 95% доверительным интервалом)
исследований или метаанализов, т.е.
соотношением вероятности терапевтической
эффективности.
В настоящее
время принята последовательная тактика
лечения НЯК. Лечение в период обострения
определяется степенью тяжести рецидива,
а терапия в период ремиссии определяется
выбором терапии во время обострения
заболевания.
Терапевтические
подходы в период обострения заболевания
определяются тяжестью клинических
проявлений. Для оценки активности НЯК
чаще используется так называемый индекс
Truelove, который включает оценку частоты
стула, наличие видимой крови в кале,
повышение температуры тела, анемию,
тахикардию и СОЭ (рис. 1).
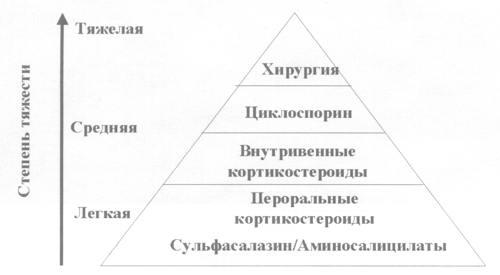
Так,
при легком и среднетяжелом обострении
назначаются аминосалицилаты, пероральные
кортикостероиды, в более тяжелых случаях
кортикостероиды назначаются внутривенно.
При неэффективности кортикостероидной
терапии возможно использование
циклоспорина. И последним этапом лечения
остается тотальная колэктомия.
Наиболее
широко для лечения обострения НЯК
продолжают использоваться аминосалицилаты
и кортикостероиды. Их эффективность
была доказана в многочисленных
плацебо-контролируемых исследованиях.
В 1930 г. д-р Swartz (Швеция), пытаясь создать
новый препарат для лечения ревматоидного
артрита и комбинируя салицилаты
(5-аминосалициловую кислоту) и сульфаниламид
(сульфапиридин), открыла салазосульфапиридин
(сульфасалазин). Первые результаты
лечения ревматоидного артрита были не
слишком впечатляющими, но затем она
применила этот препарат у больных
язвенным колитом в сочетании с поражением
суставов и получила грандиозные
результаты. Внедрение сульфасалазина
в лечение НЯК открыло новые возможности
терапии данного заболевания: была
найдена альтернатива глюкокортикоидам
и появилась возможность проведения
поддерживающей терапии.
В
одном из метаанализов было показано,
что при лечении дистальной формы НЯК
доказанно эффективны в сравнении с
плацебо назначаемые местно 5-аминосалицилаты.
Однако дозозависимый эффект доказан
не был, т.е. аминосалицилаты в дозе от
0,5 до 1,5 г в виде суппозиториев или от 1
до 4 г в виде клизм одинаково эффективны.
Другой метаанализ подтвердил, что
кортикостероиды эффективнее плацебо,
однако при сравнении местных
кортикостероидов с местным использованием
5-аминосалицилатов последние были
эффективнее. При тотальном поражении
толстой кишки аминосалицилаты в дозе
выше 3 г/сут также превзошли эффект
плацебо (рис. 2). Отмечена достоверно
более высокая эффективность сульфасалазина
по сравнению с месалазином в исследованиях
длительностью не более полугода, при
увеличении сроков исследования
достоверное различие утрачивалось,
однако тенденция сохранялась (рис. 3).
Хотя общепринято, что терапевтическим
эффектом обладает 5-аминосалициловая
кислота, результаты многочисленных
исследований показали, что собственно
сульфасалазин оказывает противовоспалительное
действие, отличающееся от 5-аминосалициловой
кислоты. Так, было установлено, что
сульфасалазин подавляет фосфолипазу
А, ключевой фермент каскада арахидоновой
кислоты, и блокирует рецепторы к фактору
некроза опухоли. Эти данные подтверждаются
клиническими наблюдениями значительно
более высокой эффективности сульфасалазина
по сравнению с 5-аминосалициловой
кислотой при лечении ревматоидного
артрита, в связи с этим при сочетании
хронических воспалительных заболеваний
кишечника с поражением суставов
рекомендуется использование сульфасалазина.
Значительную часть побочных эффектов
сульфасалазина, как токсических
(дозозависимых), так и аллергических
(дозонезависимых), приписывают
сульфокомпоненту. Только свободная,
несвязанная, метаболизированная
(глюкоронированная) форма сульфапиридина
способна вызывать побочные эффекты,
что в свою очередь связано со способностью
больного как ацетилятора. В группе
быстрых ацетиляторов дозозависимые
(токсические) побочные эффекты наблюдались
значительно чаще. Очень частые
нежелательные побочные эффекты, такие
как тошнота, рвота и головная боль, в
большинстве случаев исчезают после
уменьшения дозы. Однако развивающиеся
реже аллергогиперергические реакции
(например, агранулоцитоз, гемолитическая
анемия) требуют немедленной отмены
препарата.
Согласно последним
исследованиям начало терапии с малой
дозы 0,5 г/сут с постепенным подъемом
дозы в 3 раза в течение 4–6 дней значительно
снижает частоту вышеперечисленных
токсических побочных эффектов. Для
предотвращения аллергических реакций
предлагаются различные варианты
направленной десенсибилизирующей
терапии.
При тяжелых формах
НЯК целесообразно использование
кортикостероидов в дозе 40–60 мг
преднизолонового эквивалента в сутки
с постепенным снижением дозы 10–5 мг в
неделю после достижения клинического
эффекта. При отсутствии эффекта на
введение больших доз преднизолона в
течение 7–14 дней возможно применение
циклоспорина в дозе 4 мг на 1 кг массы
тела внутривенно с переходом через 3–7
дней на пероральный прием из расчета 5
мг/кг в сутки в течение 4–6 мес. Основанием
для продолжения лечения циклоспорином
в течение столь длительного срока после
достижения ремиссии служит ожидание
первого эффекта азатиоприна, применяемого
в качестве средства поддержания ремиссии.
Антибактериальное лечение и парентеральное
питание хотя и назначаются в тяжелых
случаях, эффективность этих мероприятий
не доказана.
Ремиссионная
терапия определяется выбором препаратов
для лечения острого процесса. Так, для
поддержания ремиссии после использования
местных и системных форм аминосалицилатов
переходят на поддерживающую дозу в той
же форме введения. Риск развития рецидива
доказанно снижается при постоянном
приеме поддерживающей дозы аминосалицилатов,
причем при дистальном колите более
эффективно местное введение. При
тотальном колите приблизительно
одинаково эффективны 5-аминосалицилаты
и сульфасалазин. После кортикостероидной
терапии возможно использование
аминосалицилатов в поддерживающей дозе
(0,75–2 г/сут), а также переход на цитостатики:
азатиоприн из расчета 2 мг на 1 кг массы
тела или 6-меркаптопурин. После циклоспорина
применяются только цитостатики. По
данным одного из исследований,
поддерживающая доза цитостатиков
позволяет избежать колэктомии в 66%
случаев, в то время как при сочетании с
5-АСК этот процент значительно ниже:
всего 40 (рис. 4). В большинстве случаев
резистентность к лечению обусловлена
слишком низкой дозировкой препаратов.
Необходимо применение только доз
препаратов, зарекомендовавших себя
эффективными в рамках исследований.
Рис.
1. Индекс активности НЯК (индекс Truelove).
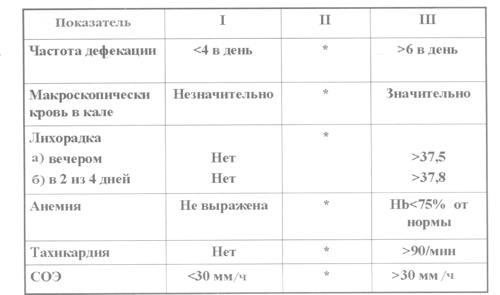
Рис.
5. Пирамида терапии при обострении НЯК.
Прогресс
в понимании патогенеза воспалительных
заболеваний кишечника привел к внедрению
новых препаратов, воздействующих на
иммунную систему и воспалительный
ответ. К таковым можно отнести инфликсимаб,
блокатор фактора некроза опухоли альфа.
Фактор некроза опухоли альфа относится
к ключевым цитокинам, принимающих
участие в развитие воспалительных
заболеваний кишечника. В отношении
эффективности инфликсимаба при лечении
НЯК не проведено ни одного крупного
рандомизированного контролируемого
исследования. Результаты одного
контролируемого и нескольких
неконтролируемых исследований
свидетельствуют, что инфликсимаб может
быть использован при лечении обострения
НЯК. Однако другое небольшое контролируемое
исследование подтвердило его
неэффективность при стероидорефрактерном
язвенном колите. Учитывая разнонаправленность
полученных результатов, планируется
проведение крупного плацебо-контролируемого
исследования.
К сожалению,
в случаях тяжелого, резистентного к
терапии тотального НЯК, а также при
развитии осложнений может потребоваться
проведение хирургического
вмешательства. Абсолютными
показаниями являются:
•
перфорация,
• кишечная
непроходимость,
• токсический
мегаколон,
• абсцесс,
•
кровотечение,
• высокая
степень дисплазии или рак толстой
кишки.
Относительными
служат:
•
неэффективность консервативной терапии
при выраженной активности,
•
задержка развития у детей и подростков,
•
фистулы,
• низкая степень
дисплазии эпителия.
Необходимость
хирургического лечения в течение жизни
возникает приблизительно у 20% больных,
что значительно ниже, чем при болезни
Крона, при которой вероятность
хирургического вмешательства в течение
20 лет заболевания достигает
90%.
Поучит
Стандартом
хирургического лечения при НЯК в
настоящее время служит тотальная
колэктомия с наложением поуч-анастомоза.
Воспаление данного искусственно
сформированного резервуара (поучит) в
течение первых двух лет после операции
развивается примерно у 30% больных.
Воспаление может принимать острый и
хронический характер. Последний
наблюдается приблизительно у 5% больных
поучитом. В качестве препаратов первого
выбора для лечения поучита применяются
антибиотики (метронидазол 400 мг 2–3 раза
в сутки или ципрофлоксацин 250–500 мг 2
раза в сутки) в течение 14 дней. При их
неэффективности может потребоваться
смена антибактериального препарата. В
отношении применения аминосалицилатов,
кортикостероидов и иммуносупрессоров
не существует данных исследований,
поэтому эти препараты могут быть
использованы только как индивидуальное
пробное лечение. Новейшие исследования
подтверждают эффективность при
хроническом поучите определенных
пробиотиков. При резистентных к терапии
формах поучита может потребоваться
экстирпация поуча с наложением стомы.
Диета
при НЯК
Относительно
эффективности назначения диеты при НЯК
на сегодняшний день пока не опубликовано
ни одного метаанализа, и современное
состояние проблемы можно оценить лишь
на основании рандомизированных
клинических исследований. Из 11
опубликованных исследований в 6
применялись ненасыщенные омега-3-жирные
кислоты или рыбий жир. В остальных
исследованиях оценивали эффективность
элиминационной диеты, дополнительного
питания, богатого балластными веществами.
Величина исследований достаточно
небольшая (11–105 больных), что зачастую
усложняло статистическую обработку
данных. Период наблюдения составлял от
7 мес до 1 года. По полученным данным,
назначение рыбьего жира не изменяет
естественное течение заболевания,
однако статистическая достоверность
ограничена размером исследований.
Однако в двух исследованиях было
достигнуто значимое снижение дозы
кортикостероидов и прибавка массы тела
при обострении заболевания.
Таким
образом, суммируя сказанное выше, схема
ведения больных НЯК выглядит как показано
на рис. 5.
Психосоциальные
аспекты
Традиционно
воспалительные заболевания кишечника
рассматривались как пример
«психосоматических» заболеваний,
что связано с тем, что больные и их
родственники часто связывают начало
заболевания или возникновение обострения
с пережитым стрессом или другими
психологическими факторами. Однако
нужно помнить, что данное предположение
не удалось подтвердить в ходе контролируемых
клинических исследований. По данным
исследований, нет типа личности, который
предрасполагал бы к развитию воспалительного
заболевания кишечника. Вполне понятно,
что у пациентов развиваются вторичные
изменения психики, связанные с зависимостью
от рецидивов, приема лекарственных
препаратов, посещений врача. Значимость
психотерапевтического лечения для
течения заболевания также не подтверждена.
Особое внимание необходимо уделить
социальной и профессиональной адаптации
пациента, что требует доверительных
отношений между врачом и больным.
Прогноз
С
момента внедрения в клиническую практику
кортикостероидов и сульфасалазина
статистика смертности от НЯК изменилась
коренным образом. До эры кортикостероидов
смертность при тяжелом обострении
превышала 30%, в настоящее время – менее
2%. В целом ожидаемая продолжительность
жизни при НЯК практически не отличается
от таковой в среднем в популяции (через
15 лет заболевания – 94,2%). Основными
причинами смерти помимо основного
заболевания остаются колоректальный
рак, бронхиальная астма и различные
патологии печени неалкогольной
этиологии.
Без проведения
поддерживающей терапии в ремиссионный
период примерно у половины больных
обострение


