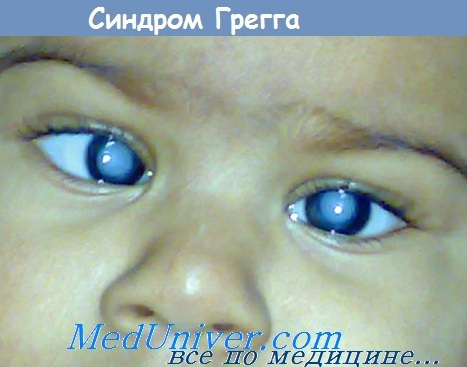
Из чего делают вакцину краснухи
Вакцина против краснухи культуральная живая
Инструкция по медицинскому применению — РУ № ЛП-000463
Дата последнего изменения: 27.04.2017
Лекарственная форма
Лиофилизат для приготовления раствора для подкожного введения.
Состав
Одна прививочная доза (0,5 мл) содержит:
Действующее вещество:
Аттенуированный штамм RA 27/3 вируса краснухи не менее 1000 тканевых цитопатогенных доз (ТЦД50).
Вспомогательные вещества:
Стабилизатор — смесь 0,100 мл водного раствора ЛС-18 (сахароза — 250 мг, лактоза — 50 мг, натрий глутаминовокислый — 37,5 мг, глицин — 25 мг, L-пролин — 25 мг, Хенкса сухая смесь с феноловым красным — 7,15 мг, вода для инъекций — до 1 мл) и 0,025 мл 10 % раствора желатина.
Описание лекарственной формы
Лиофилизат — однородная пористая масса светло-желтого цвета, допускается розоватый оттенок. Гигроскопична.
Восстановленный препарат — прозрачная жидкость розового цвета.
Характеристика
Препарат готовят методом культивирования аттенуированного штамма вируса краснухи RA 27/3 на диплоидных клетках человека MRC-5.
Фармакологическая группа
МИБП-вакцина.
Показания
Профилактика краснухи.
В соответствии с Национальным календарем профилактических прививок вакцинацию проводят в возрасте 12 мес, ревакцинацию — в 6 лет.
Национальный календарь профилактических прививок предусматривает вакцинацию детей в возрасте от 1 года до 18 лет, женщин от 18 до 25 лет (включительно), не болевших, не привитых, привитых однократно против краснухи, не имеющих сведений о прививках против краснухи.
Противопоказания
- аллергические реакции на компоненты вакцины;
- острые инфекционные и неинфекционные заболевания, обострение хронических заболеваний;
- иммунодефицитные состояния; злокачественные заболевания крови и новообразования;
- беременность и период грудного вскармливания;
- сильная реакция (подъем температуры выше 40°С, отек, гиперемия более 8 см в диаметре в месте введения вакцины) или осложнение на предыдущую дозу вакцины.
Примечание
При наличии ВИЧ-инфекции допускается вакцинация лиц с 1 и 2 иммунными категориями (отсутствие или умеренный иммунодефицит).
Применение при беременности и кормлении грудью
Проведение вакцинации противопоказано.
Способ применения и дозы
Непосредственно перед использованием вакцину разводят растворителем (вода для инъекций) из расчета 0,5 мл растворителя на одну прививочную дозу вакцины. Во избежание вспенивания вакцину растворяют, слегка покачивая ампулу. Вакцина должна полностью раствориться в течение 3 мин. Растворенная вакцина представляет собой прозрачную жидкость розового цвета. Не пригодны к применению вакцина и растворитель в ампулах с нарушенной целостностью, маркировкой, а также при изменении их физических свойств (цвета, прозрачности и др.), неправильно хранившиеся.
Вскрытие ампул и процедуру вакцинации осуществляют при строгом соблюдении правил асептики и антисептики. Ампулы в месте надреза обрабатывают 70° спиртом и обламывают, не допуская при этом попадания спирта в ампулу. Для разведения вакцины отбирают весь необходимый объем растворителя и переносят его в ампулу с сухой вакциной. После перемешивания вакцину набирают другой иглой в стерильный шприц и используют для вакцинации.
Вакцину вводят только подкожно в дозе 0,5 мл в область плеча (на границе между нижней и средней третью плеча с наружной стороны), предварительно обработав кожу в месте введения вакцины 70° этиловым спиртом.
Растворенная вакцина используется немедленно и хранению не подлежит.
Проведенную прививку регистрируют в установленных учетных формах с указанием наименования препарата, даты вакцинации, дозы, предприятия-изготовителя, номера серии, срока годности, реакции на прививку.
Побочные действия
После введения вакцины могут наблюдаться следующие побочные реакции различной степени выраженности, частота развития которых указана согласно рекомендациям Всемирной организации здравоохранения и включает следующие категории:
Часто (1/10-1/100):
- необильная кожная сыпь, лимфоаденопатия (увеличение преимущественно затылочных и заднешейных лимфоузлов) возможна у 1-2 % привитых.
Нечасто (1/100-1/1000):
- в течение 24 ч в месте введения может развиться кратковременная гиперемия, отек и уплотнение, сопровождающиеся болезненностью.
Редко (1/1000-1/10000):
- у некоторых привитых на 6-14 день может развиться кратковременное повышение температуры до субфебрильных величин, сопровождающееся катаральными явлениями и возможностью развития конъюнктивита.
Указанные реакции характеризуются кратковременным течением и проходят без лечения.
Очень редко (<1/10000):
- тромбоцитопеническая пурпура (развивается чаще с 5 по 21 день после вакцинации);
- аллергические реакции немедленного типа, в том числе анафилактические.
Артралгия, артрит; эти реакции возникают через 1 -3 недели после иммунизации, их частота различается в зависимости от возраста и пола.
Взрослые женщины:
Очень часто (e1/10), частота может доходить до 25 %;
Подростки (девочки):
Часто (1/10-1/100), частота не превышает 5 %;
Дети раннего возраста, взрослые мужчины:
Очень редко (<1/10000).
Передозировка
Случаи передозировки не установлены.
Взаимодействие
Вакцинация против краснухи может быть проведена одновременно (в один день) с другими календарными прививками (против коклюша, дифтерии, столбняка, эпидемического паротита, кори, полиомиелита, гепатита В) или не ранее, чем через 1 месяц после предшествующей прививки. При одновременной вакцинации препараты вводят в разные места, смешивание вакцин в одном шприце запрещается.
После введения препаратов крови человека (иммуноглобулин, плазма и др.) вакцину вводят не ранее, чем через 3 месяца. После введения вакцины против краснухи препараты крови можно вводить не ранее, чем через 2 недели; в случае необходимости применения иммуноглобулина ранее этого срока вакцинацию против краснухи следует повторить через 3 месяца. При наличии антител к вирусу краснухи в сыворотке крови повторную вакцинацию не проводят.
Туберкулиновые пробы рекомендуется проводить до или через 4-6 недель после введения вакцины против краснухи.
После назначения иммунодепрессантов и лучевой терапии вакцинацию проводят не ранее, чем через 12 месяцев после окончания лечения.
Меры предосторожности
Учитывая возможность развития аллергических реакций немедленного типа (анафилактический шок, отек Квинке, крапивница) у особо чувствительных лиц, за привитыми необходимо обеспечить медицинское наблюдение в течение 30 мин. Места проведения прививок должны быть обеспечены средствами противошоковой терапии.
Особые указания
Вакцинация женщин детородного возраста проводится при условии, что женщины на момент вакцинации не беременны и будут принимать меры предосторожности во избежание зачатия в течение 2 месяцев после вакцинации. Случайная вакцинация беременной женщины не является показанием к прерыванию беременности.
После острых инфекционных и неинфекционных заболеваний, обострений хронических заболеваний вакцинацию проводят не ранее, чем через 1 месяц после выздоровления.
Сведения о возможном влиянии лекарственного препарата на способность управлять транспортными средствами, механизмами.
Сведения отсутствуют.
Форма выпуска
Лиофилизат для приготовления раствора для подкожного введения.
По 1 дозе вакцины в ампуле вместимостью 2 мл. В пачке 10 ампул с инструкцией по применению и вкладышем с номером укладчика.
Условия хранения
Условия хранения.
При температуре от 2 до 8 °С. Хранить в недоступном для детей месте.
Условия транспортирования.
В соответствии с СП 3.3.2.3332-16 при температуре от 2 до 8 °С.
Срок годности
2 года. Препарат с истекшим сроком годности применению не подлежит.
Условия отпуска из аптек
Для лечебно-профилактических учреждений.
Вакцина против краснухи культуральная живая — инструкция по медицинскому применению — РУ № ЛП-000463 от 2018-05-23
Вакцина против краснухи культуральная живая — инструкция по медицинскому применению — РУ № ЛП-000463 от 2018-05-23
Источник
February 28th, 2011, 03:10 pm
Из чего сделаны наши вакцины
Знаете ли Вы, что многие вакцины сделаны из клеток абортивного материала? Обычно, когда об этом начинаешь говорить с людьми, они очень удивляются. Религиозные люди зачастую начинают нервничать. Например, католические медицинские организации выступают против ряда прививок, которые разрабатывались или изготавливаются на основе абортивного материала, а также проводят кампанию за создание этической альтернативы прививок с использованием детской крови.
Тем не менее, если заглянуть в инструкцию по применению вакцины против краснухи живой аттенуированной, то можно увидеть, что «Вакцина против краснухи живая аттенуированная готовится методом культивирования аттенуированного штамма вируса краснухи Вистар RА 27/3 на диплоидных клетках человека.«
Да и само название этой широко используемой ныне вакцины (RA/27/3) расшифровывается как:
«R» — «краснуха» (лат. rubella);
«А» – «аборт»;
«27» – 27-й абортированный тестированный зародыш, у которого смогли выделить активный вирус краснухи;
«3» – третья по счету выборка ткани…
Кошмар, ужас, невинно убиенные младенцы? Нет. Никто не делает специально аборты для получения материала для вакцин. Абортивный материал для клеточной линии был взят один раз, много лет назад. На его основе были созданы непрерывно размножающиеся клетки (те самые клеточные линии), которые и используются для экспериментов и производства вакцин.
Данные о используемой клеточной линии производитель вакцин указывает в информационном вкладыше инструкции к вакцине.
Например, краснушный вакцинный вирус выращивают в культуре диплоидных клеток легочных фибробластов человека (линия WI-38). Изначально это была ткань 3-месячного эмбриона женского пола. Беременность была прервана в 1961 г. в США (родители считали, что у них уже и так слишком много детей).
Ещё одна линия — MRC-5 была получена из тканей легких 14-ти недельного мужского эмбриона в Великобритании в 1966 г. (беременность 27-летней женщины была прервана по психиатрическим показаниям).
Предлагаем ознакомиться с материалами американского католического сайта, посвященного данной проблеме. Цель данных материалов — поднять практически не обсуждаемый сегодня в России вопрос и начать разговор о непростой проблеме. Надеемся на помощь в построении правильной картины происходящего и отклик специалистов: врачей, иммунологов, педиатров. В самом низу приведена сводная таблица вакцин, выращенных на клеточных линиях, исходно полученных от абортивного материала (с указанием существования или отсутствия альтернативной этической вакцины).
Вакцины, изготовленные из клеток абортированных человеческих плодов. Заявление Католической Медицинской Ассоциации
В настоящее время возникает этический вопрос в связи с вакцинами, изготовленными из тканей абортированных плодов. Таковыми являются вакцина от краснухи (Meruvax), гепатита А (VAQTA , HAVRIX) и некоторые другие. Встает вопрос о степени «соучастия во зле»* изготовителей, распространителей и потребителей вакцины. Размышляя о нравственных принципах такого соучастия, авторы документа пришли к следующим выводам:
1. Что касается формального сотрудничества, нравственно недопустимым является такое соучастие, как одобрение, разделение намерения или совершения аборта с целью извлечения ткани для производства вакцин. Участвующие в этом участвуют в тяжком зле, которым является аборт.
2. Что касается изготовления, распространения и продажи вакцин, таковая деятельность рассматривается как безнравственная, так как «может привести к поощрению дальнейших добровольных абортов с целью производства вакцин»*. Следовательно, вовлеченные в эту сферу могут быть виновны в безнравственной материальной заинтересованности, в зависимости от степени их вовлечения в подобную деятельность – даже если формально они не сотрудничают в этой области.
3. Что касается врачей и пациентов, которые используют эти вакцины, зная об их происхождении, им позволяется использовать препараты в том случае, если нет эффективной альтернативы и только в виду «серьезной угрозы их здоровью» и «косвенной угрозы здоровью населения»*. Такой выбор «является вынужденным и против совести…Такая вынужденная мера несправедлива и должна как можно скорее быть устранена.»*
Что касается степени соучастия, мы должны «всеми мерами противостоять изготовлению вакцин, не имеющих этических альтернатив, чтобы под нашим давлением были созданы альтернативные вакцины».
Католическая Медицинская Ассоциация предлагает следующие рекомендации, чтобы обеспечить наличие вакцин, изготовленных нравственно приемлемым способом (в дальнейшем будем называть их «альтернативные вакцины»):
1. При наличии альтернативных вакцин, они должны быть использованы взамен изготовленных безнравственным путем.
2. При отсутствии альтернативных вакцин «правильным будет воздержаться от вакцинации, если это не сопряжено с риском для здоровья ребенка и косвенной угрозой здоровью населения»*. Принимая решение, родители должны сознавать, что не существует абсолютной гарантии, что невакцинированный от краснухи ребенок не представит угрозу для здоровья беременной женщины.
3. При отсутствии альтернативных вакцин использование вакцин из абортивных материалов оправдано «на временной основе» и «только как необходимость», чтобы избежать серьезной угрозы индивидуума или общества.
4. При отсутствии альтернативных вакцин «наша нравственная обязанность бороться всеми легальными способами» и оказывать давление на фармацевтическую промышленность, правительство и национальную систему здравоохранения в целях создания этической альтернативы. Нужно проводить выступления, требуя у Пищевой и Лекарственной Администрации Америки (FDA , Food and Drug Administration разрешения на лицензию таких этических альтернативных вакцин как Takahishi (от краснухи) и Aimmugen (от гепатита А). Мы также настаиваем на точной подписи препаратов, а также осознанном, информированном выборе потребителя по поводу использования вакцин, изготовленных на абортивных материалах.
В заключение, Католическая Медицинская Ассоциация приветствует сотрудничество частных лиц и организаций в попытке обеспечить граждан нравственно приемлемыми вакцинами. Мы верим, что объединение по этическим вопросам здравоохранения существенно важно в эру быстро развивающихся медицинских технологий, чтобы обеспечить свободу совести.
* «Размышления о нравственном аспекте вакцин, изготовленных из клеток абортированных человеческих плодов» Папская академия в защиту жизни, июнь 2005
Позиция Ватикана по данному вопросу
США и Канада: список вакцин из абортивных материалов и их этические альтернативы
| Болезнь | Наименование продукта | Производитель | абортивная клеточная линия | Этическая альтернатива | Производитель | Линия |
| Ветрянка | Varivax, Varilrix | Merck, GSK | WI-38, MRC-5 | Не существует | ||
| Гепатит A | Vaqta, Havrix, Avaxim, Epaxal | Merck, GSK, Sanofi, Berna | MRC-5, MRC-5 | Aimmungen | Kaketsuken (Japan & Europe) | Vero (обезьяна) |
| Гепатит А, Гепатит В, тиф | Twinrix, Vivaxim | GSK, Sanofi | MRC-5, MRC-5 | Engerix Hep-B, Comvax Hep-B | GSK, Merck | Дрожжи |
| Корь- свинка- краснуха | MMR, Priorix | Merck, GSK | RA273, WI-38 | Не существует | ||
| Корь-краснуха | MR Vax, Eolarix | Merck, GSK. | RA273, WI-38, RA273, MRC-5 | Attenuvax (только корь) | Merck | Эмбрион цыпленка |
| Свинка-краснуха | Biavax II | Merck | RA273, WI-38 | Mumpsvax (только свинка) | Merck | Эмбрион цыпленка |
| Краснуха | Meruvax II | Merck. | RA273, WI-38 | Takahashi | Kitasato Institute, (Япония и Европа) | Кролик |
| Корь-свинка-краснуха +ветрянка | ProQuad/MMR-V | Merck. | RA273, WI-38, MRC-5 | Не существует | ||
| Полиомиелит | Poliovax, DT Polio Adsorb. | Sanofi Pasteur | MRC-5 | IPOL | Sanofi Pasteur | Vero (обезьяна) |
| Combination (DTaP + polio+ HiB) (АКДС + полио + менингит) | Pentacel, Infanrix, Quadracel | Sanofi Pasteur | MRC-5 | Pediacel; Pediarix + HiB, IPOL + any DTaP | Sanofi, GSK | Vero (обезьяна) |
| Бешенство | Imovax | Sanofi Pasteur | MRC-5 | RabAvert | Chiron | Эмбрион цыпленка |
| Ревматический артрит | Enbrel | Amgen | WI-26 VA4 | Спрашивать доктора | ||
| Сепсис | Xigris | Eli Lilly | HEK-293 | Спрашивать доктора | ||
| Опоясывающий лишай | Zostavax | Merck | WI-38, MRC-5 | Не существует | ||
| Новое: оспа | Acambis 1000 | Acambis | MRC-5 | ACAM2000, MVA3000 | Acambis/Baxter | Vero, Эмбрион цыпленка |
| Готовится: Ebola (геморрагическая лихорадка) | TBA | Crucell/NIH | PER C6 | Не существует | ||
| Готовится: грипп, птичий грипп Flu, Avian Flu | TBA | MedImmune, Vaxin, Sanofi | PER C6, HEK-293 | FluVirin, Flu Shield, Flumist, FluZone, FluBlok | Chiron, Medimmune, Sanofi ,Protein Science | Эмбрион цыпленка, гусеница |
| Готовится: ВИЧ | MRKAd5 HIV-1 | Merck | PER C6 | Не существует |
Примечание: Впрыскивание иммуноглобулина обеспечивает временную иммунизацию от краснухи (три месяца) и гепатита А (4-6 месяцев)
При производстве АКДС соответствующие клеточные линии не используются. Они необходимы только для вирусных вакцин.
Дополнительно:
Источник
Источник
Лиофилизат для приготовления раствора для п/к введения в виде однородной пористой массы белого или слегка розового цвета.
| 1 доза (0.5 мл) | |
| вакцина краснушная живая (вакцинный штамм RA 27/3) | 1000 ТЦД50 |
Вспомогательные вещества: сорбитол, желатин, L-аргинин а хлорид, мальтоза, лактальбумина гидролизат, L-аланин, натрия хлорид, неомицина сульфат не более 25 мкг.
Растворитель: вода д/и — 5 мл.
1 доза (0.5 мл) — флаконы (50) в комплекте с растворителем (0.5 мл амп. 50 шт.) — коробки картонные.
Живая аттенуированная вакцина для профилактики краснухи. Аттенуированный вакцинный вирус (штамм Wistar RA 27/3M) культивируется на диплоидных клетках человека.
Специфический иммунитет развивается в течение 15 дней после вакцинации и, в соответствии с имеющимися данными, сохраняется не менее 20 лет.
Профилактика краснухи у детей, независимо от пола, начиная с возраста 12 мес; профилактика краснухи у невакцинированных или не болевших краснухой девушек пре- и постпубертатного возраста и женщин детородного возраста.
Вакцинацию проводят одной дозой вакцины однократно, вводят п/к или в/м.
Более вероятно у взрослых. Незначительное увеличение лимфатических узлов, редко — сыпь и повышение температуры тела начиная с 5-го дня после вакцинации.
Врожденные и приобретенные иммунодефициты (включая вызванный ВИЧ-инфекцией); введение иммуноглобулинов, по крайней мере, в течение 6 недель до вакцинации, беременность.
Вакцина краснушная (живая) противопоказана к применению при беременности.
Рекомендуется не планировать беременность в ближайшие 2 мес после вакцинации. Применение данной вакцины у женщин на ранних стадиях еще не установленной беременности не является показанием для прерывания этой беременности
Решение вопроса о вакцинации ребенка, родившегося от ВИЧ-инфицированной матери, и определение его иммунного статуса откладывают до достижения возраста 9-10 мес, т.к. материнские IgG, проникшие через плаценту, могут сохраняться в крови ребенка вплоть до возраста 14 мес. Если после указанного срока ребенок признается ВИЧ-инфицированным, то для решения вопроса о вакцинации требуется заключение врачебного консилиума. Если ребенок признается неинфицированным, проводят обычную вакцинацию.
Не применимо.
В течение минимум 2 месяцев после вакцинации женщинам детородного возраста следует применять эффективные методы контрацепции.
Применение данной вакцины у женщин на ранних стадиях еще не установленной беременности не является показанием для прерывания этой беременности.
Решение вопроса о вакцинации ребенка, родившегося от ВИЧ-инфицированной матери, и определение его иммунного статуса откладывают до достижения возраста 9-10 мес, т.к. материнские IgG, проникшие через плаценту, могут сохраняться в крови ребенка вплоть до возраста 14 мес. Если после указанного срока ребенок признается ВИЧ-инфицированным, то для решения вопроса о вакцинации требуется заключение врачебного консилиума. Если ребенок признается неинфицированным, проводят обычную вакцинацию.
Вакцина краснушная (живая) может быть введена совместно с другими вакцинами. Наиболее широко применяется комбинированная вакцина для профилактики кори, паротита и краснухи.
В связи с возможной инактивацией вакцинного штамма сывороточными антителами, вакцинацию не проводят в течение 6 недель (по возможности, в течение 3 мес) после введения иммуноглобулинов или других препаратов крови, а также после введения вакцины в течение 2 недель не применяют иммуноглобулины.
После вакцинации туберкулиновая проба в течение некоторого времени может быть ложноотрицательной.
Представлено описание активных веществ лекарственного препарата. Приведенная научная информация является обобщающей и не может быть использована для принятия решения о возможности применения конкретного лекарственного препарата.
Источник