Камень в почке и цирроз
Поражение почек у больных циррозом печени значительно ухудшает прогноз заболевания. В статье представлены диагностические критерии хронической болезни почек, острой болезни почек, острого повреждения почек и методы их лечения.

Таблица 1. Дефиниции заболеваний почек у пациентов с циррозом печени

Таблица 2. Стадии острого повреждения почек у больных циррозом печени
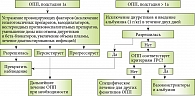
Алгоритм наблюдения и лечения больных циррозом печени с острым почечным повреждением

В среднем у 5–7% больных циррозом печени различной этиологии ежегодно наблюдается декомпенсация заболевания [1–3]. Декомпенсированный цирроз печени – заболевание с мультиорганной (системной) дисфункцией. Декомпенсированной стадии заболевания предшествует стадия компенсации (асимптомная стадия), когда клинические симптомы заболевания отсутствуют. Средняя продолжительность жизни пациентов с компенсированной стадией заболевания – 12 лет.
Существуют три стадии компенсированного цирроза печени:
- стадия 0: отсутствуют признаки портальной гипертензии и варикозно расширенные вены пищевода (ВРВП), измерение жесткости печени (liver stiffness measurement, LSM) > 15, но 5, но
- стадия 1: ВРВП отсутствуют, определяется значимая портальная гипертензия – LSM ≥ 20 или давление в воротной вене ≥ 10 мм рт. ст.;
- стадия 2: имеют место ВРВП и значимая портальная гипертензия.
Декомпенсация цирроза печени (симптомная стадия) характеризуется наличием клинических признаков заболевания, средняя продолжительность жизни не превышает двух лет. Манифестация декомпенсированного заболевания часто сопровождается кровотечением из ВРВП. Конечная стадия декомпенсации цирроза печени характеризуется развитием рефрактерного асцита, печеночной энцефалопатии или желтухи, почечной недостаточности, присоединением инфекции [1, 3, 4].
О функциональном состоянии почек судят по уровню креатинина крови и снижению скорости клубочковой фильтрации (СКФ).
Критерии почечной недостаточности у пациентов с циррозом печени были определены более 30 лет назад и базировались на уровне креатинина ≥ 1,5 мг/дл, что соответствовало показателю СКФ ≤ 40 мл/мин/1,73 м2. Важно, что у пациентов с заболеваниями печени даже незначительное увеличение уровня креатинина крови может вызывать заметное снижение СКФ. Тем не менее диагноз почечной дисфункции при заболеваниях печени все еще основан на показателях креатинина крови [5, 6]. В случае повышения уровня креатинина крови и снижения СКФ у пациентов с заболеванием печени необходимо исключить хроническую болезнь почек (ХБП), острую болезнь почек (ОБП), острое повреждение почек (ОПП) или их сочетание (табл. 1).
Цирроз печени может сопровождаться ХБП, обусловленной сопутствующими заболеваниями, например сахарным диабетом, артериальной гипертензией и/или такими заболеваниями почек, как IgA-нефропатия, вирусная гломерулопатия.
Распространенность ХБП у пациентов с циррозом печени до сих пор не изучена. Диагноз ХБП основывается на снижении СКФ на протяжении трех и более лет (СКФ 2). СКФ рассчитывается по формулам, учитывающим уровень креатинина, наличие (отсутствие) признаков повреждения почечной паренхимы (протеинурия, гематурия, анормальные значения ультрасонографии). Стадия ХБП определяется исходя из уровня снижения СКФ [7–9].
Критерием ОБП служит повреждение почек, зафиксированное в течение менее трех месяцев: СКФ снижается менее 60 мл/мин/1,73 м2, или на 35% и более, либо уровень креатинина увеличивается на 50% и более за указанный промежуток времени.
В настоящее время вместо термина «острая почечная недостаточность» используется термин «острое повреждение почек», предложенный экспертами Международной организации по улучшению глобальных результатов лечения заболеваний почек KDIGO (Kidney Disease: Improving Global Outcomes) [10, 11]. При ОПП не отмечается каких-либо структурных изменений почек. Диагноз основан на увеличении уровня креатинина сыворотки крови в 1,5 раза по сравнению с исходным (если это известно или предполагается, что увеличение уровня произошло в течение предшествующих семи дней, или абсолютное увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более – на протяжении двух дней).
Следует подчеркнуть, что диагностика ОПП, согласно критериям KDIGO, может базироваться как на уровне креатинина сыворотки крови, так и на объеме выделяемой мочи. То есть, исходя из данных критериев, диагноз ОПП правомерен и при объеме мочи менее 0,5 мл/кг/ч за шесть часов [11–13]. Однако, согласно новому консенсусу Международного асцитического клуба (International Ascites Club), объем мочи не учитывается при диагностике ОПП у больных циррозом печени. Это объясняется тем, что больные циррозом печени с асцитическим синдромом часто страдают олигурией с выраженной задержкой натрия, несмотря на относительно нормальную СКФ, объем мочи у них может повышаться на фоне применения диуретиков [14].
Новая система разделения ОПП на стадии основана на процентном увеличении уровня креатинина сыворотки крови у больных циррозом печени по сравнению с базовым уровнем (начальная стадия) либо при пиковом значении креатинина во время госпитализации в случае прогрессирующего ОПП (пиковая стадия). У пациентов с циррозом печени значение креатинина в течение последних трех месяцев, до его повышения, следует рассматривать как базовое. Согласно критериям KDIGO, стадия 1 соответствует увеличению креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и более, или в 1,5–2 раза от базового. Стадия 2 ОПП соответствует увеличению уровня креатинина сыворотки крови более чем в два раза, но менее чем в три раза. Стадия 3 верифицируется при увеличении уровня креатинина более чем в три раза (табл. 2) [11].
Как показали результаты недавних исследований, у пациентов с циррозом печени со стадией 1 ОПП эффективность терапии зависит от уровня креатинина сыворотки крови. Его увеличение более чем на 1,5 мг/дл (132,6 мкмоль/л) ассоциируется с худшим прогнозом [15–17]. В отличие от системы KDIGO эксперты Международного асцитического клуба предложили разделять стадию 1 на подстадии 1а (креатинин
С учетом системы стадирования и результатов нескольких проспективных исследований был предложен новый алгоритм лечения ОПП у пациентов с циррозом печени (рисунок) [14]. При подстадии 1а (увеличение уровня креатинина до значений менее чем 1,5 мг/дл (132,6 мкмоль/л)) в некоторых случаях достаточно устранить провоцирующие факторы: отменить гепатотоксические препараты, нестероидные противовоспалительные препараты, уменьшить дозу или отменить диуретики и бета-блокаторы, увеличить объем плазмы, пролечить диагностированные инфекции. Но уже с подстадии 1b кроме полной отмены диуретических препаратов рекомендовано вводить альбумин из расчета 1 г на 1 кг веса больного на протяжении двух дней. Если после двухдневного лечения признаки ОПП сохраняются, необходимо исключить наличие у пациента гепаторенального синдрома (ГРС) или других видов ОПП.
У больных циррозом печени могут наблюдаться все виды ОПП – преренальное, ГРС, ренальное, острое тубулярное, постренальное повреждение [8]. Необходимо дифференцировать ГРС от острого тубулярного некроза. Конечно, возможно разграничение различных вариантов повреждения с помощью пункционной биопсии почек. В отличие от острого тубулярного некроза при ГРС отсутствуют морфологические изменения в почках. Поскольку биопсия почки редко проводится при ОПП, в настоящее время предлагают использовать биомаркеры. Для дифференциальной диагностики между острым тубулярным некрозом и ГРС целесообразно определять в моче липокалин, ассоциированный с желатиназой нейтрофилов. Концентрация этого белка в моче и крови значительно повышается в первые часы после развития ОПП. Подобный анализ позволяет быстро установить диагноз и назначить адекватную терапию. Скорее всего этот тест в будущем получит широкое распространение в клинической практике [18–22].
Экспертами Международного асцитического клуба классификация ГРС была пересмотрена. Сегодня выделяют два типа ГРС. Тип 1 соответствует ГРС-ОПП, тип 2 подразумевает нарушение функции почек, соответствие критериям ГРС, но не ОПП (не-ОПП-ГРС).
Согласно критериям Международного асцитического клуба, ГРС-ОПП возникает только при наличии у больных декомпенсированным циррозом печени асцита и признаков ОПП (увеличение уровня креатинина на 0,3 мг/дл (≥ 26,5 мкмоль/л) и выше на протяжении 48 часов, или на 50% и более на протяжении семи дней). При диагностике ГРС-ОПП необходимо исключить шок, органическое поражение почек (отсутствие протеинурии и микрогематурии и структурных изменений почек по данным ультрасонографии), доказать отсутствие в анамнезе приема в ближайшее время нефро- и гепатотоксических препаратов, улучшение в течение двух дней после отмены диуретических средств и назначения альбумина в дозе 1 г на 1 кг веса пациента [14, 23].
Всем пациентам c ГРС-ОПП со стадией выше 1а необходимо незамедлительно назначить вазоконстрикторы и альбумин с госпитализацией в палату интенсивной терапии. Препаратом выбора из вазопрессоров является терлипрессин (Реместип). Препарат повышает тонус гладких мышц сосудистой стенки, вызывает сужение артериол, вен и венул в большей степени в брюшной полости, уменьшает кровоток в гладкомышечных органах и печени, снижает давление в портальной системе. Препарат можно вводить внутривенно болюсно (1 мг каждые 4–6 часов) или непрерывно внутривенно, 2 мг/сут. Если через два дня лечения уровень креатинина снижается менее чем на 25% пикового, дозу терлипрессина следует увеличить до максимальной – 12 мг/сут. При недоступности терлипрессина его можно заменить норадреналином. Если недоступны оба препарата, можно использовать мидодрин и октреотид, хотя их эффективность ниже. Одновременно с вазопрессорами вводится 20%-ный раствор альбумина, его суточная доза – 20–40 г. Для предупреждения перегрузки кровообращения целесообразно измерять центральный объем крови с титрованием дозы альбумина [24–29].
Профилактика ГРС основана на введении раствора альбумина пациентам с асцитическим синдромом, у которых не исключен риск развития спонтанного бактериального перитонита. В случае его верификации альбумин вводят из расчета 1,5 мг на 1 кг веса, на третий день от постановки диагноза – в дозе 1 мг на 1 кг веса пациента [30, 31].
Кроме того, в качестве профилактики спонтанного бактериального перитонита и развития на его фоне ГРС-ОПП используют норфлоксацин 400 мг/сут.
Источник
Поражение почек встречается у 10-20% лиц, страдающих заболеваниями печени, проявляясь различными вариантами от незначительного мочевого синдрома до быстропрогрессирующей необратимой почечной недостаточности. Одно время намечалась тенденция объединять все варианты содружественного поражения почек и печени под одним термином «гепаторенальный синдром», однако в настоящее время наблюдается стремление к дифференцированию как патогенетических путей, так и клинико-морфологических вариантов.
На современном этапе обсуждаются два основных патогенетических механизма, приводящих при заболеваниях печени к поражению почек, развитию «печеночной» нефропатии:
1) нарушение почечного кровотока;
2) прямое воздействие на почки токсических метаболитов, антител, иммунных комплексов.
Снижение почечного кровотока закономерно развивается при заболеваниях печени. Причинами нарушения почечной гемодинамики являются резкое повышение почечного сосудистого сопротивления под влиянием каких-то медиаторов, выделяемых больной печенью или недостаточно инактивируемых ею, а также перераспределение почечного кровотока, подтвержденное радио-изотопными исследованиями с 133Хе и ангиографией; меньшее значение в последние годы придается гиповолемии, развивающейся вследствие секвестрации крови в сосудах портальной системы.
Среди возможных медиаторов почечной вазоконстрикции называют ферритин, ароматические амины, бактериальный эндотоксин, ренин, кинины. При тяжелых циррозах печени, особенно при гепаторенальном синдроме, в крови резко повышен уровень ренина и ангиотензина II [Schroeder Е. et al., 1970; Wong P. et al., 1977], вызывающих почечную вазоконстрикцию, и снижен уровень брадикинина, увеличивающего почечный кровоток путем активации синтеза простагландина Е. Блокада простагландин-синтетазы индоцидом вызывает у больных циррозом обратимую почечную недостаточность [Reynolds Т. et al., 1976].
Обсуждается возможность развития почечной вазоконстрикции за счет неврогенных влияний в ответ на изменения внепочечного кровообращения. Уменьшение ренального кровотока наблюдается при стимуляции симпатических сосудистых сплетений вокруг сосудов печени, при внепеченочной портальной гипертензии в клинике и эксперименте. В связи с этим высказано предположение о существовании порторенального рефлекса, угнетающего почечный кровоток.
Почки могут поражаться и за счет токсического действия печеночных метаболитов — билирубина и желчных кислот, алкоголя, развития локальной внутрисосудистой коагуляции.
Сравнительно недавно стало изучаться участие иммунологических механизмов в патогенезе «печеночной» нефропатии. Антитела к почечной ткани обнаруживаются при остром вирусном гепатите, хроническом активном гепатите и первичном билиарном циррозе печени.
Существует предположение о наличии в ткани печени и почек близких антигенов, дающих перекрестные реакции. Однако при развитии «печеночного» ГН наиболее вероятен иммунокомплексный генез его. При вирусных и алкогольных гепатитах и циррозах в крови обнаруживают циркулирующие иммунные комплексы, при вирусных циррозах в почках находят австралийский антиген, антитела к нему, реже — другие иммуноглобулины [Brzosko W. et al., 1974; McIntosh R., 1976]. В сыворотке крови больных алкогольным циррозом печени резко повышен уровень IgA, нередко секреторного типа (Andre F. et al., 1976] и обнаруживаются в высоком титре антитела к IgA [Wilson I. et al., 1972]; в почечных клубочках выявляется иммунолюминесценция IgA и С3 [Nochy D. et al., 1976].
Возможна и роль нарушений клеточного иммунитета. При хроническом активном гепатите и первичном билиарном циррозе может наблюдаться инфильтрация почечной ткани малыми лимфоцитами, обнаруживается сенсибилизация лимфоцитов не только к антигенам печени, но и к мукопротеину Tamm—Horsfall, специфичному для эпителия дистальных почечных канальцев [Cochrane A. et al., 1976].
Разнообразие «печеночно-почечных связей», а также механизмов, с помощью которых пораженная печень влияет на почки, приводит к развитию различных клинико-морфологических вариантов печеночной нефропатии. Основными являются гепаторенальный синдром, ГН, печеночный гломерулосклероз, почечный канальцевый ацидоз, пиелонефрит.
Клиническая нефрология
под ред. Тареева Е.М.
Опубликовал Константин Моканов
Источник
 Где находится печень, а где почки? Казалось бы, далеко друг от друга. Но, так или иначе, почки могут страдать не только от камней или своих внутренних поражений, но и при нарушениях другого, не менее важного, в данном случае, органа – печени. Они обеспечивают, отмечает prokishechnik, фильтрацию крови, выводят токсины и прочие вредные вещества, а также перерабатывают некоторые из них, разлагая на более простые. Все лишнее выводится из организма всем известным способом. Но нас сегодня интересует интересный момент – заболевание печени может провоцировать серьезные проблемы с почками, а значит, оказывать не менее значимое влияние на здоровье человека. Поэтому давайте поговорим об этом.
Где находится печень, а где почки? Казалось бы, далеко друг от друга. Но, так или иначе, почки могут страдать не только от камней или своих внутренних поражений, но и при нарушениях другого, не менее важного, в данном случае, органа – печени. Они обеспечивают, отмечает prokishechnik, фильтрацию крови, выводят токсины и прочие вредные вещества, а также перерабатывают некоторые из них, разлагая на более простые. Все лишнее выводится из организма всем известным способом. Но нас сегодня интересует интересный момент – заболевание печени может провоцировать серьезные проблемы с почками, а значит, оказывать не менее значимое влияние на здоровье человека. Поэтому давайте поговорим об этом.
Насколько известно ПрокишечникРу, примерно от 10 до 20% людей имеют заболевание почек то или иной сложности, которое вызвано патологией печени начиная от простого мочевого синдрома, заканчивая серьезным скоротечным и неизлечимым заболеванием – почечной недостаточностью. Раньше даже выделяли отдельный диагноз «гепаторенальный синдром».
Причины
Современные реалии разделили проблему на две причины: врожденные проблемы и появление онкологии. К врожденным патологиям сегодня относят очень много различных заболеваний, например, анатомические аномалии, врожденный нефрит, удвоение почек (https://nefrol.ru/bolezni/udvoenie-pochek.html ) и т.д. Но если рассматривать именно проблемы с печенью, то, как правило, сейчас можно четко сказать, что есть две причины, по которым может возникнуть поражение почек, приводящее к «печеночной» нефропатии и все это, как правил, происходит на фоне заболевания печени следующим образом:
- При воздействии токсинов на ткани почек (токсических метаболитов, антител или иммунных комплексов);
- Нарушение почечного кровотока;
Токсины
Нарушение движения крови происходит вследствие резкого повышения сосудистого сопротивления в самой почке, которое, в свою очередь, вызывается медиаторами печени или тем, что плохо инактивировались внутри ее. Также подобное происходит и при перераспределении кровотока, которое подтверждается радиоизотопными исследованиями и ангиографией органа.
К медиаторам, приводящим к нарушению почечного кровообращения за счет сужения сосудов, относят:
- ферритин,
- ароматические амины,
- ренин, кинины
- бактериальный эндотоксин.
Когда развивается цирроз печени, и если к этому еще прибавляется и гепаторенальный синдром (нарушение работы почек при гипертензии) может наблюдаться резкое повышение в крови таких показателей, как ренин и ангиотензин II, при этом происходит снижение брадикинина. Последний активирует синтез простагландина Е, который и увеличивает кровоток в сосудах.
Если удается с помощью индоцида обеспечить блокаду выработку простагландина, то, как считает прокишечникРу, здоровье больного, у которого наблюдается цирроз, можно восстановить, избавив его от почечной недостаточности.
Нарушение кровотока
Также к причинам появления проблем с кровообращением относят неврогенный характер. Такое происходит из-за нарушений внепочечного кровообращения. В таком случае активируются симпатические сосудистые пучки (сплетения), расположенные вблизи сосудов самой печени.
Основываясь на таких данных, ученые предположили, что, скорее всего, это связано с порторенальным рефлексом, который угнетает почечный кровоток. Также пагубное воздействие на почки оказывает токсическое действие печеночных метаболитов, которые образуются при работе печени. К ним относятся желчные кислоты и билирубин, в том числе алкоголь.
Диагностика
И только совсем недавно, насколько известно ProKishechnikRu, ученые обратили свое внимание на иммунологические механизмы, которые происходят при печеночной нефропатии. Так стало возможно определять антитела почечной ткани, которые проявляются при наличии острого вирусного и хронического гепатита, а также при первичном билиарном циррозе. Также многие из докторов считают, что можно найти схожие антигены в тканях почек и печени.
Насколько известно ПроКишечникРу, при наличии у больного алкогольного гепатита или вирусного его типа, в его крови можно заметить иммунные комплексы. При вирусном циррозе можно найти в тканях почки австралийский антиген и антитела к нему же.
Видео по теме
Заключение
Если кратко подвести итог данной статьи, то можно выделить основную мысль: так или иначе, если есть поражение печени, это может оказывать пагубное воздействие на работу почек, и довести дело до печеночной нефропатии. Многие врачи игнорируют это, но пациентам стоит помнить об этом, чтобы обратить внимание специалиста на возможные подобные взаимосвязи.
Статья подготовлена благодаря
Источник


