Кандидоз бактериологический метод диагностики
При поверхностных микозах (кератомикозах)
патологический процесс локализуется
преимущественно в поверхностных слоях
эпидермиса, не вызывая при этом видимой
воспалительной реакции в
дерме. В эту группу входят следующие
микозы.
Разноцветный
лишай (отрубевидный лишай). Возбудителем
является дрожжеподобный гриб Pityrosporumorbicutare
(Malasseriafurfur).
Заболевание
чаще
возникает у лиц молодого возраста при
чрезмерной потливости, при сахарном
диабете, ожирении,
длительной лихорадке. Очаги поражения
локализуются на коже груди, спины,
живота, шеи, плечах, проявляясь в виде
коричнево-красных пятен, сопровождающихся
шелушением.
Диагностика
проводится микроскопическим методом.
В
нативных препаратах соскоба кожи
элементы
гриба в
чешуйках рогового слоя выглядят в виде
коротких
нитей мицелия, а также скоплений округлых
почкующихся
клеток с толстой стенкой, размером до
8мкм в диаметре. При посеве материала
от больного на среду Сабуро при на 4-8-й
день культивирования при температуре
370
С появляются белые или кремовые колонии
с блестящей поверхностью, состоящие
из почкующихся дрожжеподобных клеток.
Черный
микоз (кладоспориоз). Возбудитель
— Cladosporiumwerneckii
вызывает появление
на коже ладоней или подошв светло-коричневых
или черных пятен,
шелушение отсутствует.
При
микроскопии нативных препаратов элементы
гриба обнаруживаются
в роговом слое
эпидермиса в виде коричневого ветвящегося
септированного мицелия и почкующихся
клеток.
Пьедра.
Заболевание
кутикулы волоса, характеризующееся
образованием на волосе узелков белого
или черного цвета.
Белая
пьедра (трихоспороз), встречаетсяв
виде спорадических случаев в странах
с умеренным климатом, возбудителем
является Trichosporonbeigelii
(Trichosporoncutaneum).При
микроскопии пораженных волос находят
мицелий и артроспоры,
прямоугольной, овальной или круглой
формы, а также
скопления спор. Узелки локализуются на
волосах подмышечной и паховой
областей, на бороде и волосистой части
головы.
Черная
пьедра, наоборот,
встречается в странах с жарким климатом.
Возбудитель — Piedraiahortai—
имеет аски, в которых находятся от 2 до
8 аскоспор размером
от 5 до 80мкм.
Лабораторная диагностика микозов, вызываемых условно-патогенными грибами (оппортунистические микозы)
Условно-патогенные
грибы обычно являются сапрофитами,
обитающими во внешней среде, а
также на коже и слизистых оболочках
человека. Оппортунистические микозы
возникают при длительном
контакте человека
с возбудителем, на фоне иммунодефицита,
нерациональной антибиотико-
и химиотерапии, приводящей к дисбактериозу
и т. д. Некоторые грибы в
благоприятных для них условиях способны
размножаться в пищевых продуктах
(например, в злаках) и накапливать
сильнодействующие микотоксины, вызывающие
тяжелые пищевые отравления (алиментарные
микотоксикозы).
Кандидоз (кандидамикоз)
Возбудителями
кандидоза – повсеместно распространенного
заболевания являются дрожжеподобные
грибы родаCandida
(наиболее
часто встречается видCandidaalbicans,
реже —Candidatropicalis,
Candidapseudotropicalis,
Candidakrusei,
Candidaglabrata
и т.д.).
Кандидоз
относится к типичным аутоинфекциям,
проявляясь избыточным ростом дрожжеподобных
грибов, заселяющих кожу, ногти, слизистые
оболочки, внутренние органы. Обычно это
заболевание возникает при патологии,
связанной с формированием иммунодефицита
(сахарный диабет, другие эндокринные
болезни, гипо- и авитаминозы,
иммунодепрессивная и лучевая терапия,
СПИД и т.д.), при дисбактериозе, обусловленном
длительным приемом антибиотиков.
Наиболее
подвержены кандидозу дети и старики.
Выделяют
поверхностный кандидоз слизистых
оболочек, кожи, ногтевых валиков и
ногтей. Кандидоз слизистых оболочек
полости рта или влагалища (молочница)
характеризуется появлением белого
налета, напоминающего
свернутое молоко
Хронический
генерализованный кандидоз
обычно развивается у детей с
иммунодефицитными состояниями, имеет
медленно прогрессирующее течение с
возникновением пневмоний,
гастритов, гепатитов и др.
При
висцеральном кандидозе поражаются
желудочно-кишечный
тракт, органы дыхания, мочевыделительная
система, ЦНС.
Аллергические
формы кандидоза развиваются на фоне
имеющегося первичного очага
кандидомикоза в результате сенсибилизация
организма, при этом могут возникать
новые очаги воспаления, в которых
возбудитель отсутствует.
Материалом
для исследования при кандидозе являются
чешуйки кожи и соскоб с ногтей,
отделяемое и пленки со слизистой оболочки
губ, полости рта,
влагалища, мочеиспускательного канала,
наружного
слухового прохода, а также с конъюнктивы.
При висцеральном кандидозе
исследуют кровь, спинномозговую жидкость,
мокроту, испражнения, мочу, желчь, мазки
со слизистых
оболочек, биоптаты тканей, пунктаты
абсцессов, секционный материал.
Лабораторная
диагностика кандидоза включает
микроскопию
нативных препаратов, выделение чистой
культуры гриба, обнаружение в материалах
антигенов или нуклеиновых кислот,
постановку серологических
реакций, аллергических проб.
Микроскопический
метод — изучение
неокрашенных и окрашенных по Граму,
Романовскому-Гимзе, Цилю-Нильсену
препаратов из исследуемого материала,
в которых обнаруживают
круглые или овальные почкующиеся
дрожжеподобные клетки, размером
от 3-6 мкм, и псевдомицелий в виде цепочек
удлиненных клеток (рис. 37).
Некоторые
виды дрожжеподобных грибов (C.albicans)
образуют
терминальные хламидоспоры.
По Граму
грибы рода Candidaокрашиваются
в темно-фиолетовый
цвет, по
Цилю-Нильсену
— в
синий с розово-желтыми
включениями липидов,
по Романовскому-Гимзе
— в розовато-желтый цвет с
темно-фиолетовыми включениями
волютина и красным хроматиновым
веществом.
Микологическое
исследование. Выделение
чистой культуры дрожжеподобных грибов
производят
на плотных средах (обычно среде Сабуро,
сусло-агаре, Кандида-агаре или
др.) с добавлением антибиотиков
(пенициллин, стрептомицин и т.д.) для
подавления роста сопутствующих бактерий.
Через
2-3 дня культивирования при 30-370
С образуются круглые,
диаметром
до 1 см, выпуклые сметанообразные гладкие
колонии белого цвета с ровными краями
и глубоким врастанием в среду ветвистого
древовидного псевдомицелия.
Выделенную
чистую культуру пересевают в жидкие
среды ( картофельную, кукурузную среды,
морковно-картофельный отвар и др.)
для
выявления псевдомицелия, появляющегося
обычно на
3-5
день культивирования (реже на 10-15 день
и позже) В жидких
питательных средах Candidaобразуют равномерное
помутнение,
осадок или пленку на поверхности среды.
Наряду
с псевдомицелием,
у этих грибов можно найти истинный
мицелий и
хламидоспоры
(крупные
двухконтурные споры
с зернистым содержимым) при посеве на
рисовый
или Хламидоспор-агар с последующим
культивированием гриба в условиях
пониженной температуры и концентрации
кислорода..
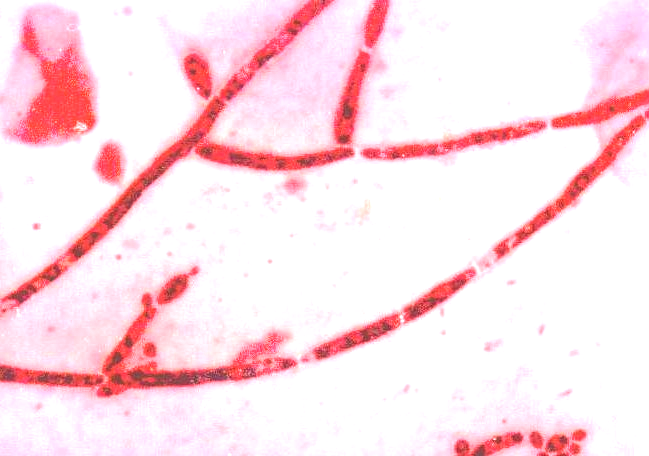
Рис.
37. Возбудитель кандидамикоза
(Candidaalbicans)
в
исследуемом материале
Бластоспоры
(почки)
у дрожжеподобных грибов рода Candida
располагаются нерегулярно по обеим
сторонам мицелия, хламидоспоры круглые,
крупные (10-20мкм),
двухконтурные. C.albicansсбраживает
глюкозу, мальтозу, левулезу и частично
галактозу;
молоко не изменяет.
Идентификация
дрожжеподобных грибов рода Candidaдо
уровня вида основывается на определении
типа филаментации,
наличия хламидоспор, ферментативной
активности (табл.
24).
Таблица 24. Сахаролитические
свойства дрожжеподобных грибов рода
Candida.
Вид гриба | Сахара | ||||
глюкоза | мальтоза | лактоза | галактоза | сахароза | |
Candidaalbicans | кг | кн | — | кг | — |
Candida | кг | кг | — | кг | кг |
Candida pseudotropicalis | кг | — | кг | кг | кг |
Candida krusei | кг | — | кг | — | — |
Обозначения: кг – расщепление субстрата
с образованием кислоты и газа
Характерным
дифференциальным признаком,
отличающим вид С.
Albicans
от других видов дрожжеподобных грибов
рода Candida,
является их способность образовывать
ростовые трубки —
трубкообразные выросты бластоспор
(признак РТ).
Для этого часть
колонии грибов
переносят в 0,5 мл стерильной
сыворотки теленка, пробирки
помещают в термостат при 370
С на 2,5-3,0
часа, после чего готовят препарат
раздавленной капли и микроскопируют
под большим увеличением микроскопа
(объектив х40). У ростовых
трубок отсутствует перемычка или
сужение на месте соединения с бластоспорой,
они тоньше, чем
удлиненная бластоспора или псевдомицелий
у С. tropicalis.
Для
дифференциации с другими грибами у
культур дрожжеподобных грибов определяют
наличие капсулы и уреазы (у кандид они
отсутствуют), определяют способность
ассимилировать и ферментировать
углеводы
(глюкозу, мальтозу, сахарозу, галактозу
и др.).
Для
быстрой идентификации С.
albicansразработаныспециальные
диски с хромогенными субстратами,
позволяющие выявить специфичные для
этого вида грибов ферменты
L-пролинаминопептидазу
и 3-галактозамидазу. На диск наносят
суточную культуру гриба,
инкубируют 30 мин при 35 °С, затем добавляют
1
каплю 0,3%-го раствора гидроксида натрия.
Появление
желтого окрашивания свидетельствует
об активности L-пролинаминопептидазы.
Затем добавляют 1 каплю коричного
альдегида;
развитие в течение 1 мин розово-красного
окрашивания свидетельствует
о наличии 3-галактозамидазы. Положительный
тест на оба фермента в сочетании с
наличием ростовых трубок считаются
достаточными для идентификации С.
albicans.
Серологический
метод (постановкаРСК,
РА, ИФА. РНГА, ВИЭФ и др. с парными
сыворотками
крови больных с целью определения
специфических антител)
обычно
проводится
при висцеральных формах кандидоза.
Результаты
исследования считают
положительными при нарастании титра
антител более чем в 4 раза в динамике
заболевания.
Для РА используются корпускулярные
антигены, для РСК
очищенные полисахариды,
лизаты
или ультразвуковые дезинтеграты
дрожжеподобных грибов.
Аллергологический
метод (преимущественно
у больных висцеральным кандидозом)
—
постановка внутрикожной аллергической
пробы со стандартным кандидозным
аллергеном, представляющим взвесь
клеток грибов, прогретую при 800
С в течение
2 ч. Результаты
реакции (гиперемия,
папула) учитывают через 24 — 48 ч. В связи
с широким распространением
сенсибилизации к антигенам грибов
аллергопроба имеет ограниченное
диагностическое значение.
Генодиагностика
— разработана ПЦР для инидикации
видоспецифического фрагмента
ДНК С.
albicans.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
… грибы рода Candida размножаются на любом биологическом субстрате.
В связи с тем, что для заболевания кандидозом характерен полиморфизм клинических проявлений лабораторному исследованию подлежит разнообразный патологический материала. В зависимости от характера и локализации поражения, для лабораторного анализа берут:
• мокроту;
• соскобы с кожи или слизистых оболочек;
• ногтевые чешуйки;
• кровь, ликвор, мочу, желчь, фекалии;
• пунктаты из закрытых полостей, отделяемое свищей;
• биопсированный и секционный материал.
Вначале производят исследование нативного материала (за исключением крови); при этом ликвор, мочу и желчь подвергают (!) предварительному центрифугированию (1500 — 2000 об/мин, 10 — 15 мин). Препараты готовят в 10 — 20% растворе щелочи при слабом нагревании.
Обнаружение нитчатой фазы возбудителя (мицелия или псевдомицелия) является важным свидетельством наличия кандидоза. Количество дрожжевых клеток в каждом поле зрения служит ориентиром при подготовке серийных разведений для количественного посева на плотные питательные среды: единичные клетки в поле зрения при большом увеличении микроскопа (х400) свидетельствуют об их содержании порядка десятков тысяч в 1 мл исследуемого материала.
Разведения патологического материала, содержащего нормальную микрофлору (мокрота, фекалии, моча, желчь и т.д.), готовят в жидкой питательной среде (обычно жидкое сусло или жидкая среда Сабуро) и затем высевают определенное количество материала (0,1 — 0,2 мл) на аналогичные плотные среды. Для подавления роста контаминирующих бактерий в среды добавляют антибактериальные антибиотики (чаще всего применяют пенициллин и стрептомицин: по 50 — 100 ед/мл среды или 0,05% хлорамфеникола).
Если вместо соскобов использованы смывы, то тампоны предварительно встряхивают в течение нескольких минут в 5 — 7 мл жидкой питательной среды, а затем производят посев на плотные среды определенного объема соответствующего разведения исходной взвеси. Соскобы с кожи и ногтевых пластинок помещают на скошенные питательные среды. Посев крови и ликвора производят в 10-кратный объем жидкой среды Сабуро или МПБ с 2% глюкозы без добавления антибиотиков, так как кандидозная фунгемия иногда сочетается с бактериальным сепсисом. Наиболее высокую эффективность выделения грибов из крови удалось обеспечить при использовании комбинированной сердечно-мозговой среды. Посев крови делают 3-4-кратно, осуществляя забор из разных вен с интервалом в несколько дней при (1) отсутствии парентерального питания или (2) капельного введения лекарственных веществ. При наличии у больного фунгемии рост грибов появляется через 24-48 ч, максимальная инкубация осуществляется до 30 суток при периодических пересевах на плотную питательную среду.
Биопсированный и секционный материал используют для приготовления гистологических препаратов (окраска PAS-методом), а остатки материала высевают (методом отпечатков или после предварительного измельчения) на плотные и в жидкие питательные среды. Инкубацию предпочтительнее проводить при 25 — 30оС, хотя патогенные для человека виды грибов хорошо растут и при 37оС. Достаточных размеров колонии формируются через 48 ч культивирования, хотя точечный рост можно обнаружить уже на следующий день после первичного посева. При отсутствии роста на агаровых средах делают высев с жидких питательных сред на сектора для получения изолированных колоний.
При исследовании мочи наряду с культуральным методом рекомендуется дополнительное исследование, имеющее целью (!) выявление иммуноглобулинов человека на поверхности бластоспор. Для этого около 5 мл второй порции мочи центрифугируют в течение 5-10 мин при 1500 об/мин и из осадка готовят (1) нативные препараты и мазки, окрашенные по Граму, а также (2) препараты для иммунолюминесцентного исследования при котором фиксацию осуществляют метанолом, а после высушивания мазка наносят антисыворотку против глобулинов человека, меченную изотиоцианатом флюоресцеина.
В осадке мочи больных мочекаменной болезнью нередко (около 7% проб) присутствуют клетки золотистого стафилококка (В.Г. Кубась и соавт.), которые за счет наличия у них белка А неспецифически связывают Fc-фрагменты IgG, что может привести к получению ложноположительных результатов реакции иммунолюминесценции. При выявлении грамположительных кокков для блокировки белка А рекомендовано (В.Г. Кубась и соавт.) к осадку мочи добавлять равный объем кроличьего глобулина с концентрацией белка 1,0 мг/мл. После (1) инкубации смеси при 37оС в течение 30 мин и (2) 3-кратного промывания осадка фосфатным буферным раствором (3) готовят мазки и (4) фиксируют их метанолом. Предварительная обработка кроличьим глобулином взвесей золотистых стафилококков (100-500 млн/мл) подавляла их неспецифическую флюоресценцию.
Выявление светящихся дрожжевых клеток при параллельном обнаружении дрожжей в нативном и окрашенном по Граму препаратах свидетельствует о том, что они несут на своей поверхности специфические глобулины, то есть о наличии у пациента тканевых поражений. Положительный антиглобулиновый тест свидетельствует о кандидозном поражении мочевыводящих путей. Контролем для исключения аутофлюоресценции дрожжевых клеток является исследование неокрашенного препарата.
(!) Видовое определение выделенных культур является важным критерием диагностики и имеет комплексный характер, включающий (1) изучение внешнего вида колонии, (2) ферментативной активности и (3) ассимиляционной способности штамма, (4) типа филаментации, а также (5) характера роста в жидкой питательной среде (наличие поверхностной пленки, поднимающееся по стенке пробирки над поверхностью среды кольцо и т.д.). Большинство патогенных для человека видов грибов рода Candida может быть идентифицировано без постановки ассимиляционного теста.
Из-за резкого преобладания C. albicans у больных и миконосителей, у выросшей культуры прежде всего выявляют наличие характерного морфологического признака этого вида — хламидоспоры. С этой целью производят прерывистый штриховой посев на рисовый агар, часть посева покрывают фламбированным покровным стеклом. Посевы инкубируют при 37оС или при 22оС. Подавляющее большинство штаммов C. albicans образуют хламидоспоры через 12-24 ч, реже — через 48 ч. Выявление хламидоспор позволяет идентифицировать культуру как C. albicans и не проводить дальнейших исследований. Культуры, у которых хламидоспоры выявить не удалось, исследуют по комплексу признаков.
Ферментативную активность определяют на обычных средах «пестрого ряда» или в дрожжевом аутолизате, в которых конценирация углеводов должна составлять 2%. Инкубацию проводят при 25-28оС. Некоторые штаммы могут вызывать ферментацию в поздние сроки (10-20 дней), поэтому для ускорения процесса рекомендуют использовать агаризованные Среды (0,1-0,15% агар-агара); при этом срок наблюдения сокращается до 2 дней.
При постановке ассимиляционного теста в стерильную чашку Петри вносят 1-2 мл взвеси культуры, которую заливают 18-20 мл базовой среды с добавлением дрожжевого аутолизата, охлажденной до 43-45°. После застывания агара его подсушивают и на поверхность наносят стерильные диски фильтровальной бумаги, пропитанной 20% или насыщенным раствором изучаемого источника питания. Можно также на поверхность агара наносить небольшие количества нерастворенного источника питания. Чашки инкубируют в перевернутом виде при 25-28оС; в положительных случаях в течение 2-4 дней вокруг источника питания обнаруживается рост культуры гриба.
Для выявления типов роста посев осуществляется на картофельный агар с 1% глюкозы методом «врезания»: микологическую лопатку с биомассой культуры погружают на 1/3 толщины агара, причем посев делают в виде двух сходящихся, но не пересекающихся лучей. Чашки инкубируют в течение суток при 37оС, а затем при 25оС. Нитчатая форма образуется в толще агара по периферии посева в течение 3-7 дней. При задержке филаментации культуру засевают на среду Городковой, посевы инкубируют при 22оС в течение 10-15 дней, периодически исследуя для выявления аскоспор. Также наряду с микроскопическим исследованием нативных препаратов, мазки окрашивают по Цилю-Нильсену; при этом кислотоустойчивые споры воспринимают рубиново-красную окраску. Эффективное окрашивание спор истинных дрожжей достигается при использовании 2% водного раствора фуксина.
В последнее десятилетие разработан ряд автоматизированных систем для видовой идентификации грибов рода Candida, в основу которых положено определение ассимиляционной способности изучаемых культур. Каждая лунка содержит определенный источник питания, посевы инкубируются при 30оС в течение 24 ч. Помутнение среды свидетельствует об ассимиляции данного источника питания, регистрация результатов производится фотометрически. При помощи компьютера по нумерационно-кодовому принципу осуществляют видовое определение штамма.
Серологическая диагностика. Высокую диагностическую значимость имеет реакция непрямой иммунолюминесценции. У большинства здоровых лиц ее интенсивность составляет 1:10 — 1:20, диагностическим считается титр 1 и более. Для реакции агглютинации частиц латекса, сенсибилизированных соматическими антигенами, диагностическим считают титр 1:8; у больных с выраженной иммуносупрессией диагностическое значение имеет 4-кратное увеличение титра в процессе заболевания. Для поиска антигенов гриба используют частицы латекса, сенсибилизированные антителами, но во избежание ложноположительных результатов, в сыворотке должен отсутствовать ревматоидный фактор.
При использовании встречного иммуноэлектрофореза выявление 2 и более дуг преципитации имеет диагностическую ценность. У здоровых лиц, а также у больных поверхностным кандидозом дуги преципитации, как правило, отсутствуют. При перекрестном иммуноэлектрофорезе у больных висцеральным кандидозом выявляется в среднем 10 дуг преципитации (пределы колебаний — 5-20), при кандидозном эндокардите — около 8 (1-11), а в контрольной группе — 2 (0-5). Специфичность метода увеличивается при использовании промежуточного геля с конкавалином А, который связывает маннан, содержащийся в виде примеси в препаратах соматических антигенов.
Большую ценность, чем титрование антител, имеет определение в сыворотке циркулирующих антигенов гриба, особенно цитоплазматических. Определение антигенов осложняется формированием в сыворотке иммунных комплексов. Полисахаридные антигены высвобождаются из этих комплексов кипячением, для белковых антигенов методы выделения не разработаны. При диссеминированном кандидозе маннан выявляют у 50-70% больных при его отсутствии у здоровых лиц, что придает находке диагностическую значимость. Методом газо-жидкостной хроматографии в сыворотке определяют метаболиты гриба — маннозу и арабинитол. Определение сывороточного содержания арабинитола основывается на способности некоторых видов (C. albicans, C. tropicalis, C. pseudotropicalis, C. parapsilosis) синтезировать это вещество. При почечной недостаточности рекомендуется одновременное определение концентрации арабинитола и креатинина, так как скорость выделения этих веществ одинакова.
Диагностика системного кандидоза. Своевременный диагноз системного кандидоза представляет значительные трудности, поскольку клиническая симптоматика неспецифична. В диагностике кандидоза основная роль принадлежит лабораторным методам исследования: микроскопическим, культуральным, газохроматофическим и молекулярным.
Выявление кандидемии считается наиболее значимым диагностическим маркером гематогенного кандидоза и служит абсолютным показанием к проведению противогрибковой терапии. Следует иметь в виду, что системный кандидоз может не сопровождаться кандидемией. Наиболее важным признаком диссеминированного кандидоза является грибковый эндофтальмит (экссудативные изменения желто-белого цвета сосудистой оболочки глаза). Поэтому офтальмологическое обследование считается весьма значимым в комплексе диагностики и мониторинга больных, имеющих факторы риска диссеминированной кандидозной инфекции. Однако кандидозный эндофтальмит не является начальным признаком генерализации грибковой инфекции, даже у больных с кандидемией поражение сетчатой оболочки выявляют лишь в 9-15% случаев. Другие проявления диссеминированного кандидоза (в частности, поражения кожи и артрит) отмечаются крайне редко у больных в ОИТ. После операций, не затрагивающих почки, мочевой пузырь, а также в тех случаях, когда не было длительной катетеризации мочевого пузыря, кандидурия с выделением большого числа КОЕ является весьма подозрительным симптомом гематогенного поражения почек.
Серологические методы включают определение антител к Candida spp. с помощью различных методов: (1) агглютинации, (2) иммуноэлектрофореза и (3) иммунодилюции. К сожалению, интерпретация получаемых данных часто затруднительна, поскольку антитела обнаруживаются и у здоровых людей, и в случаях обычной колонизации. Более того, эти методы дают отрицательный результат при грибковой инфекции у больных с иммунодефицитными состояниями и в начальной стадии системного кандидоза. Большей информативностью обладают серологические методы определения антигенов Candida spp., однако они также обладают лишь умеренной чувствительностью в случаях системного кандидоза.
Перспективным методом диагностики является хроматографическое определение метаболитов грибов — D-арабинитола в различных биологических жидкостях и тканях инфицированных больных. Большинство патогенных Candida spp. (кроме С. crusei и C. glabrata) продуцируют значительное количество D-изомера арабинитола, и в сыворотке больных при инвазивном кандидозе определяется его повышенное содержание, а также повышение отношения D-арабинитол/креатинин. В проспективных клинических исследованиях подтверждена значимость серийных определений D-арабинитола для диагностики кандидоза у онкологических больных с нейтропенией. Однако инвазивный кандидоз во многих случаях протекает без кандидемии, что не может не отражаться на содержании D-арабинитола в крови и снижает диагностическую ценность метода.
Весьма информативным является метод молекулярной лабораторной диагностики — полимеразная цепная реакция (ПЦР), позволяющая определить специфические области ДНК C. albicans, а также других грибов, в частности Аspergillus spp. Чувствительность ПЦР достигает 100%, а специфичность — 98%. По данным H.Einsele и соавт. (1997), положительная ПЦР позволяет в среднем на 4 дня раньше, чем при обычном обследовании, установить диагноз диссеминированного кандидоза или легочного аспергиллеза. Высокая чувствительность метода позволила K.Ikegami и соавт. (1999) определить наличие ДНК грибов в крови у более 50% больных в критическом состоянии, у которых не было фунгемии, а у многих также и признаков системной воспалительной реакции. Однако, по мнению M.Ruhnke (1999), подтверждение диагностической роли молекулярных методов исследования нуждается в дальнейших доказательных клинических исследованиях.
Источник

