Колит кишечника и дексаметазон
 Таблетки
ТаблеткиПрактически каждому второму больному воспалительным заболеванием кишечника врачи назначают прием гормональных препаратов. Цель сего действа – снизить воспаление до минимально возможного уровня. И, казалось бы, все неплохо: большинству людей с ВЗК гормоны действительно неплохо помогают. Но в нашем деле без подводных камней никак…
Что представляет собой гормональная терапия НЯК и БК? Каков механизм действия глюкокортикоидов? Почему гормоны нельзя применять всю жизнь, даже если они помогают? Постараюсь максимально подробно и доступно раскрыть эти вопросы в сегодняшней статье.
Из статьи про этапы лечения неспецифического язвенного колита вы могли узнать, по какому алгоритму действуют гастроэнтерологи, когда пытаются убрать симптоматику заболевания. Как правило, включение в “рацион” больного синтетических гормонов связано с отсутствием положительного ответа на лечение Месалазином. Когда различные Салофальки, Месаколы, Мезаванты, Пентасы и иже с ними не в силах подчинить себе НЯК или БК, настает время “тяжелой артиллерии”. А “тяжелая” она по нескольким причинам, но об этом позже.
Глюкокортикоиды – это стероидные гормоны, вырабатываемые корой надпочечников. Глюкокортикоиды человека:
- Альдостерон.
- Дезоксикортикостерон.
- Кортикостерон.
- Кортизон.
- Кортизол (гидрокортизон)
Наиболее значимым и активным глюкокортикоидом человека является кортизол, объем выработки которого превалирует над остальными вышеуказанными.
Физиологическая роль глюкокортикоидов довольно разнообразна. Эти гормоны обладают антистрессовым и антиаллергенным эффектами, играют определенную роль в метаболизме, вступают в реакцию с другими гормонами и, обращаю ваше внимание, способны оказывать влияние на иммунную систему человека, а также подавлять воспалительные процессы.
В зависимости от того, сколько глюкортикоидов поступает в ваш организм, возникает либо стимуляция работы иммунитета, либо его подавление. Интенсивность иммуносупрессии прямо пропорциональна концентрации глюкокортикоидов в крови и может быть превышать физиологические нормы более чем в 100 раз.
Помимо иммуносупрессивной функции, глюкокортикоиды обладают сильным противовоспалительным эффектом. Благодаря подавлению активности разрушающих ткани ферментов, снижению проницаемости стенок органов и сосудов, торможению экссудации (перемещения богатой белком жидкости, содержащей форменные элементы крови) и миграции лейкоцитов в очаги воспаления, замедлению пролиферации (новообразование клеток и внутриклеточных структур) в воспаленных участках и другим свойствам, глюкокортикоиды нашли свое применение в лечении таких тяжелых и малоизученных заболеваний, как неспецифический язвенный колит и болезнь Крона.
Воспалительные заболевания кишечника – это результат сбоя работы иммунной системы, вследствие чего возникают органические воспаления в органах желудочно-кишечного тракта. В зависимости от локализации и характера воспаления, врачи диагностируют либо НЯК, либо БК. Подробнее – в статье о различиях этих заболеваний. Существует мнение, что заболевания “неспецифический язвенный колит” вообще не существует, а все его проявления – это всего лишь ранняя стадия болезни Крона.
Так вот, как вы уже догадались, именно благодаря иммуносупрессивным и противовоспалительным свойствам глюкокортикоиды успешно применяются в терапии НЯК и БК (помимо ВЗК их также используют для лечения различных дерматитов, астмы, лейкоза и кучи других болезней). Но в лечении таких тяжелых заболеваний просто невозможно обойтись без побочных эффектов от применяемых лекарств, и именно глюкокортикоиды занимают, пожалуй, пальму первенства в этой сомнительной олимпиаде (не считая препараты генной инженерии).
 Рис.1 Синдром Кушинга
Рис.1 Синдром Кушинга
Наиболее распространенные гормональные препараты для лечения воспалительных заболеваний кишечника:
- Преднизолон.
- Метипред
- Буденофальк.
- Дексаметазон.
- Гидрокортизон.
- Кортимент (с недавних пор).
Все они содержат в своем составе синтетические глюкокортикоиды. Различия кроются в том, какие именно гормоны содержат эти лекарства, в концентрации активных веществ, в оболочке и степенях очистки.
В связи с не до конца изученными свойствами глюкокортикоидов, в настоящее время затруднительно досконально описать как механизм действия вышеуказанных препаратов, так и конкретные побочные эффекты от их применения. Как правило, негативные воздействия, с которыми сталкиваются больные, связаны с болью в костях и суставах, выпадением волос и наоборот их ростом в ранее “чистых” местах, ухудшением зрения, некоторыми симптомами синдрома Кушинга (рис.1) и др. Советую также ознакомиться со статьей “Внекишечные проявления НЯК и БК: причины, разновидности и способы лечения“.
Препараты синтетических глюкокортикоидов помогают не всем больным ВЗК. В нескольких публикациях я уже упоминал о гормонорезистентности и гормонозависимости, но если вкратце: как правило, ваша система ЖКТ может либо позитивно реагировать на гормональную терапию, либо нейтрально, либо негативно. К последнему можно отнести возникновение зависимости, которая характеризуется невозможностью полностью отказаться от приема лекарств ввиду возникновения первичных симптомов НЯК или БК, т.е. нарушение стула, боли в животе и ректальное кровотечение, а также возникновению вышеупомянутых побочных эффектов.
Длительный прием синтетических гормонов может стать причиной сахарного диабета, артрита, ожирения и многих других неприятных вещей. В связи с тем, что глюкокортикоиды участвуют в обмене веществ, многократное увеличение их концентрации (а мы ведь помним, что для подавления иммунитета глюкокортикоиды должны буквально зашкаливать) чревато ухудшением состояния абсолютно всех органов и систем организма. Да, вы, вероятно, получите некое подобие ремиссии НЯК или БК, но стоит игра свеч? Гормоны, в первую очередь, предназначены для того, чтобы вывести вас из критического положения. Гормоны – это не панацея, скорее даже наоборот.
Мой опыт использования глюкокортикоидов в терапии НЯК можете узнать из уже довольно старой публикации “Кортикостероиды или цитостатики?“, когда я только начинал пробовать себя в качестве автора.
В случае успешного ухода с гормональной терапии, в большинстве случаев все приобретенные “побочки” сходят на “нет” в течение 1,5-3 месяцев. Чтобы хоть как-то помочь больному, который “сидит на курсе” гормонов, врачи могут назначить ему прием препаратов кальция и специальную диету, богатую витаминами и микроэлементами.
Итак, выводы.
- Глюкокортикоиды не избавят вас от воспалительного заболевания кишечника, но помогут восстановить поврежденные ткани.
- Глюкокортикоиды нарушают обмен веществ, что приводит к появлению разного рода и степени тяжести побочных эффектов.
- Глюкокортикоиды не рекомендуется применять длительно ввиду риска возникновения гормонозависимости.
В конце хотелось бы сказать, что в любом случае не стоит опускать руки. Если и 5-АСК и глюкокортикоиды вам не помогли, обратите свое внимание на биотерапию, фитотерапию, а также следите за достижениями медицины в сфере лечения воспалительных заболеваний кишечника. Здоровья и хорошего настроения, друзья!
Источник
Гормональная терапия неспецифического язвенного колита. Питание при язвенном колите.Гормональная терапия при неспецифическом язвенном колите является также дискутабельным вопросом. В начальной стадии заболевания это лечение может принести некоторый успех. Снижается температура, уменьшаются боли в животе и кишечные расстройства, стихают воспалительные явления в кишечнике, улучшается общее состояние больного. Но эта ремиссия бывает обычно временной, непродолжительной, а затем смгняется рецидивом, иногда тяжелым, с осложнениями, которые, может быть, вызываются применением гормонов. В хронической стадии заболевания при необратимых изменениях в кишечнике применение гормональных препаратов не приносит пользы. Большинство авторов считает бесполезным и даже опасным применение гормонотерапии при неспецифическом язвенном колите. Мы присоединяемся к этому мнению. Но есть и другая, положительная, точка зрения на гормонотерапию при этом заболевании. В. К. Герасимов (1965) сообщил о результатах консервативного лечения неспецифического язвенного колита в два этапа. В первый этап проводится курс общеукрепляющей, симптоматической терапии, с целью воздействовать на вторичную кишечную инфекцию, повысить защитные иммунобиологические свойства организма, провести десенсибилизацию, устранить недостаток питания и витаминов. Этот курс состоит из применения антибиотиков, сульфаниламидных препаратов, энтеросептола, гемотрансфузий, биостимуляторов, аитигистаминных препаратов — димедрол, пипольфен, супрастии, транквилизоторов — триоксазии, мепробамат, витаминов группы В, аскорбиновой, никотиновой, фолиевой кислот, местных, способствующих эпителизации средств — рыбий жир, масло из семян шиповника.
При отсутствии эффекта от симптоматического, общеукрепляющего лечения переходят ко второму этапу лечения — гормонотерапии. В. К. Карнаухов считает, что гормонотерапии не подлежат больные с мягким, доброкачественным течением болезни, когда процесс ограничивается дистальным отделом толстой кишки и в клиническом течении преобладают симптомы невроза. Не следует также применять этот метод лечения при осложнениях и сопутствующих заболеваниях. Показанной он считает гормонотерапию у больных с прогрессирующим течением болезни, с обильным кровянисто-гнойным стулом и общими симптомами: лихорадка, эозинофилия, узловая эритема, ирит, артропатии. У лихорадящих больных целесообразно гормонотерапию применять в сочетании с антибиотиками. Из гормональных препаратов применяют следующие: АКТГ, кортизон, гидрокортизон, адрозон, преднизон, преднизолон, метикортен, триамсинолон, дексаметазон. В. В. Широбоков (1965) наряду с комплексным лечением больных применял прополис (пчелиный клей) от 0,5 до 1 г 3 раза в день и прополисные клизмы по 50 мл после акта дефекации. Прополис обладает бактерицидным действием, уничтожает гнилостную флору, повышает комплементарную активность крови, усиливает фагоцитоз, увеличивает содержание такого ценного белка, как пропердин. В общей сложности он способствует повышению естественной резистентности организма. Применяя этот метод у 98 больных, В. В. Широбоков наблюдал у 87 больных стойкие клинические ремиссии. У остальных наступило только улучшение, так как лечение было прервано. При наблюдении на протяжении 3—4 лет все больные чувствуют себя хорошо и работают. По совету одного земского врача-хирурга (А. Н. Тимофеев), мы неоднократно рекомендовали больным, страдающим неспецифическим язвенным колитом, вносить в пищевой рацион на протяжении 3—4 месяцев ежедневно грецкие орехи до 50—100 г. Съедать их нужно между приемами пищи. У многих больных, особенно с начальными, недалеко зашедшими формами заболевания, наблюдались длительные ремиссии и даже полное выздоровление. А у больной К, более подробно описанной в 19-й лекции, полное выздоровление наступило даже при тяжелой, запущенной форме заболевания. В чем тут дело и имеет ли грецкий орех положительное лечебное значение, покажут дальнейшие исследования, но первые эмпирические клинические наблюдения оставляют самые благоприятные впечатления. Ядро грецкого ореха содержит высококалорийные, легко усвояемые вещества: белки, жиры, дубильные вещества, вероятно, микроэлементы. Все эти составные части способствуют улучшению питания и обмена веществ у лиц, страдающих неспецифическим язвеиным колитом, что у многих больных сказывается в виде выраженного улучшения в течении заболевания. Итак, консервативное лечение неспецифического язвенного колита многообразно. Оно всегда проводится комплексно, нередко дает улучшение и даже полное выздоровление. Но есть больные и формы заболевания, при которых консервативное лечение или дает кратковременное улучшение, или оказывается совершенно безрезультатным. Заболевание неуклонно, быстро или более медленно прогрессирует. В этих случаях перед больным и врачом стоит одна дилемма — оперативное лечение. — Также рекомендуем «Показания к операции при неспецифическом язвенном колите. Виды операций при язвенном колите.» Оглавление темы «Неспецифический язвенный колит.»: |
Источник
В статье рассмотрена роль системных и топических кортикостероидов в терапии язвенного колита
Язвенный колит (ЯК) представляет собой хроническое идиопатическое воспалительное заболевание с повреждением слизистой оболочки толстой кишки. При ЯК поражается только толстая кишка (за исключением ретроградного илеита), в процесс обязательно вовлекается прямая кишка, воспаление чаще всего ограничивается слизистой оболочкой (за исключением фульминантного колита) и носит диффузный характер. ЯК характеризуется периодами активного проявления симптомов заболевания, которые перемежаются периодами клинической ремиссии [1]. В 2012 г. статистический анализ показал, что в мире распространенность ЯК достигла 249 на 100 тыс. человек в Северной Америке и 505 на 100 тыс. человек в Европе; самые высокие годовые показатели заболеваемости ЯК были 19,2 на 100 тыс. человеко-лет в Северной Америке и 24,3 на 100 тыс. человеко-лет в Европе [2]. Самый высокий уровень заболеваемости, по-видимому, отмечается в возрасте 20–30 лет, хотя есть некоторые доказательства второго пика заболеваемости в более позднем возрасте [2]. Однако наличие второго пика заболеваемости признается не всеми специалистами, занимающимися воспалительными заболеваниями кишечника (ВЗК).
Эндоскопическое исследование толстой кишки у больных ЯК выявляет ряд характерных повреждений слизистой оболочки толстой кишки (СОТК): отсутствие сосудистого рисунка, гиперемию, зернистость, контактную кровоточивость, наличие эрозий и язв [1, 3]. В настоящее время заживление СОТК при ЯК рассматривается как одна из ключевых конечных точек в клинических исследованиях, а достижение заживления СОТК в клинической практике – как реальная возможность изменить течение ЯК и сохранить функции кишечника. В исследованиях последних лет показано, что заживление СО как при ЯК, так и при болезни Крона (БК) достоверно связано с большей продолжительностью клинической ремиссии заболевания, более низкой частотой рецидивов, более низким риском развития колоректального рака и более высоким качеством жизни [4, 5], а также существенно меньшей частотой кол-эктомий [6].
Существующие руководства по лечению взрослых больных ЯК в США [7], Европейском союзе [8] и Российской Федерации [9] рекомендуют в качестве первой линии терапии для индукции ремиссии у пациентов с легкой и среднетяжелой формами ЯК препараты 5-аминосалициловой кислоты (5-АСК). Такое лечение считается наиболее эффективным при комбинации системных и пероральных препаратов 5-АСК [7–9]. В случае неэффективности 5-АСК препаратами второй линии являются глюкокортикостероиды (ГКС) [7–9]. Однако ГКС I поколения, такие как преднизолон, имеют ряд побочных эффектов: повышенный риск развития инфекционных осложнений, остеопороза, синдрома Иценко – Кушинга, развитие стероидного диабета, симптоматической гипертензии и даже повышенный риск смертности по сравнению с таковым в общей популяции [7, 10–12].
В настоящее время для лечения ВЗК применяется несколько глюкокортикоидов топического действия для приема внутрь и для ректального введения: будесонид, тиксокортола пиволат, беклометазон, флютиказон [13]. В России с 2004 г. зарегистрирован и успешно применяется препарат Буденофальк (компания Dr. Falk, Германия) в форме капсул для приема внутрь. Одна капсула Буденофалька содержит 3 мг будесонида. При ряде заболеваний, например при бронхиальной астме и сезонном аллергическом рините, будесонид так же эффективен, как системные ГКС, отличаясь при этом лучшей переносимостью и меньшим влиянием на гипоталамо-гипофизарно-адреналовую систему. Это послужило основанием для применения будесонида при БК. Будесонид является первым топическим кортикостероидом, имеющим сродство к глюкокортикоидным рецепторам приблизительно в 8,5, 15 и 195 раз больше, чем у дексаметазона [14], преднизолона [15] и гидрокортизона [15] соответственно. Кроме того, будесонид почти не всасывается из кишечника, характеризуется низкой системной биодоступностью (не более 10% по сравнению с таковой преднизолона и гидрокортизона) и быстрым пресистемным метаболизмом. Последнее обеспечивает отсутствие токсичных метаболитов в крови после первого прохождения препарата через печень. Однако наиболее высокая внутрипросветная концентрация действующего вещества и, соответственно, наибольшая эффективность Буденофалька достигаются, начиная с терминального отдела подвздошной кишки и до поперечной ободочной кишки.
ЯК – это хроническое заболевание, поражающее только СОТК, сопровождающееся ее воспалением, отеком и образованием язвенных дефектов. Воспаление всегда начинается с прямой кишки, непрерывно распространяясь выше вплоть до поражения СО всех отделов толстой кишки. Таблетированный мультиматричный (ММХ) будесонид является представителем II поколения кортикостероидов, созданным для доставки активного вещества на протяжении всей толстой кишки. В фармакокинетических исследованиях среднее относительное всасывание будесонида в месте между восходящей кишкой и нисходящей/сигмовидной кишкой составило 95,9% (рис. 1) [16]. В 2-х похожих по дизайну исследованиях 3-й фазы (CORE I и II) однократный ежедневный прием будесонида ММХ 9 мг оказался эффективным и хорошо переносимым для индукции ремиссии ЯК легкой и средней степени тяжести. Частота клинической и эндоскопической ремиссии составила 17,9% (CORE I) и 17,4% (CORE II) для будесонида ММХ 9 мг по сравнению с плацебо 7,4% и 4,5% соответственно (p<0,05, будесонид ММХ 9 мг по сравнению с плацебо в обоих исследованиях), 12,1% с месалазином 2,4 г и 12,6% с будесонидом 9 мг, высвобождаемым в подвздошной кишке. По данным исследования поддерживающей терапии будесонидом в течение 12 мес., будесонид ММХ 6 мг может удлинять время до рецидива заболевания: среднее время составило 1 год для будесонида ММХ 6 мг по сравнению с 181 днем (р=0,02) для плацебо; однако необходимы дальнейшие исследования. В исследованиях CORE будесонид ММХ проявил хороший профиль безопасности; большинство нежелательных явлений (НЯ) были легкими или умеренными по своей интенсивности, серьезные НЯ были очень редкими. Более того, частота побочных реакций, возможно, связанных с глюкокортикоидами, была сравнима среди групп лечения. Долгосрочная безопасность (12 мес.) будесонида ММХ была сравнима с таковой плацебо. Эти данные подтверждают возможность включения ММХ будесонида в алгоритм лечения ЯК [17–20].
Будесонид ММХ для лечения и индукции ремиссии ЯК
Эффективность и безопасность будесонида ММХ для индукции ремиссии пациентов с легкой и умеренной активностью ЯК (индекс активности заболевания 4–10) изучались в похожих по дизайну рандомизированных исследованиях CORE I и CORE II [17–20]. В CORE I сравнивали будесонид ММХ 9 мг и 6 мг с месалазином 2,4 г и плацебо, тогда как в CORE II сравнивались те же дозы будесонида ММХ с будесонидом 9 мг, высвобождающимся в подвздошной кишке, и плацебо. В обоих исследованиях терапия проводилась 8 нед., и первичными точками были клиническая и эндоскопическая ремиссия на 8-й нед. лечения. Ремиссия определялась как индекс активности ЯК ≤ 1 со значением 0 для ректального кровотечения и частоты стула, отсутствие ранимости СО при колоноскопии, и снижение ≥ 1 эндоскопического индекса от исходного значения. В обоих исследованиях клиническая и эндоскопическая ремиссия была достигнута у значительной части пациентов, получавших будесонид ММХ 9 мг (по сравнению с плацебо). В исследовании CORE I ремиссия на 8-й нед. была достигнута у 17,9% пациентов, получавших будесонид ММХ 9 мг, у 7,4% (р=0,01) в группе плацебо и у 12,1% в группе, получавшей месалазин. В исследовании CORE II частота ремиссии к 8-й нед. составила 17,4% у пациентов, получавших будесонид ММХ 9 мг, по сравнению с 4,5% (p=0,005) и 12,6% (p=0,048) в группах, получавших плацебо и будесонид, высвобождающийся в подвздошной кишке, соответственно. Кроме этого, анализ подгруппы в исследовании CORE II показал, что при приеме будесонида ММХ 9 мг существенно большая часть пациентов с левосторонним ЯК достигла клинической и эндоскопической ремиссии, чем при приеме плацебо (17,7% по сравнению с 5,8% соответственно; p=0,03); часть пациентов с распространенным заболеванием, которые достигли клинической и эндоскопической ремиссии, также была больше при использовании будесонида ММХ 9 мг, чем при использовании плацебо (13,8% по сравнению с 0% соответственно), но это различие не было статистически значимым (p=0,10). В исследовании CORE I анализ подгрупп по тяжести заболевания показал, что у пациентов с легким течением ЯК (индекс активности ЯК 4 или 5), которые получали будесонид ММХ 9 мг или плацебо, клиническое улучшение (определялось как снижение ≥ 3 баллов индекса активности ЯК) было достигнуто у 44,4% и 25,0% пациентов соответственно; у пациентов с умеренной активностью заболевания (индекс ЯК ≥ 6 и ≤10) показатели клинического улучшения составили 39,7% и 30,1% соответственно. Более того, частота заживления СО была больше при применении будесонида MMX 9 мг, чем при применении плацебо, у пациентов с проктосигмоидитом (32,4% по сравнению с 19,5% соответственно; p=0,20) и левосторонним ЯК (40,6% по сравнению с 26,5% соответственно; p=0,22). Похожее различие в пользу будесонида ММХ 9 мг наблюдалось у пациентов с распространенным ЯК (16,1% по сравнению с 10,0% при применении плацебо), но это различие также не было статистически значимым (p=0,39). В анализе исследований CORE I и CORE II пациенты, получающие будесонид ММХ 9 мг, достигали клинической и эндоскопической ремиссии в 3 раза чаще, чем при получении плацебо [ОШ 3,3 (95% ДИ 1,7–6,4)]. Будесонид ММХ 9 мг был статистически значимо более эффективен по сравнению с плацебо у нескольких групп пациентов: мужского и женского пола ≤ 60 лет; ранее принимавших месалазин; не получавших месалазин ранее; с легким течением ЯК на исходном уровне; со средней тяжестью ЯК исходно; с проктосигмоидитом; с левосторонним ЯК; с длительностью ЯК ≥ 1 года и ≤5 лет; с длительностью ЯК > 5 лет.
Будесонид ММХ 9 мг для поддержания ремиссии ЯК
Эффективность будесонида ММХ 9 мг для поддержания ремиссии была изучена у пациентов, которые достигли клинической и эндоскопической ремиссии в исследованиях CORE I и CORE II, у пациентов в исследованиях CORE I и II, которые получали дополнительно 8 нед. лечения (будесонид ММХ 9 мг), и открытом исследовании, в котором пациенты были рандомизированы на группы, получавшие будесонид ММХ 6 мг или плацебо в течение 12 мес.; первичная точка эффективности – клиническая ремиссия, которая оценивалась через 1, 3, 6, 9 и 12 мес. Среднее время до рецидива заболевания (определялось как ректальное кровотечение, частота стула более чем 1–2 р./сут или оба этих фактора) составило 181 день в группе плацебо, но не было достигнуто в группе будесонида ММХ (p=0,02); к 12 мес. вероятность рецидива составила 59,7% и 40,9% соответственно. Однако процентное соотношение пациентов, у которых ремиссия поддерживалась в течение 12 мес., не различалось существенно между группами, что, возможно, связано со статистическими недостатками исследования.
Следовательно, польза будесонида ММХ в поддержании ремиссии в настоящее время недостаточно ясна, и необходимо проведение дальнейших исследований [21].
Побочные эффекты
В целом у молекулы будесонида более благоприятный профиль безопасности, чем у I поколения пероральных кортикостероидов, таких как преднизон или преднизолон. Например, в двойном слепом исследовании в течение 10 нед. 176 пациентов с БК, которые получали преднизолон по схеме снижения или будесонид, высвобождающийся в подвздошной кишке, в течение 10 нед., частота побочных явлений, связанных с глюкокортикоидами, была значительно ниже при применении будесонида, чем преднизолона (33% по сравнению с 55% соответственно; p=0,003). Кроме этого, подавление гипоталамо-гипофизарно-надпочечниковой системы, оцениваемое с помощью измерения средней концентрации кортизола в плазме, было существенно выше при применении преднизолона, чем будесонида, высвобождавшегося в подвздошной кишке, через 4 нед. (р<0,001) и 8 нед. (р=0,02). Благоприятный профиль НЯ будесонида ММХ у пациентов с ЯК был показан в исследованиях CORE I и II.Частота НЯ у пациентов, получающих будесонид ММХ 9 мг или 6 мг, составила 57,5% и 58,7% соответственно в исследовании CORE I, 55,5% и 62,5% соответственно – в CORE II. В обоих исследованиях большинство НЯ было легкими или умеренными по интенсивности, частота серьезных НЯ была ниже и схожей во всех группах лечения. Наиболее распространенными НЯ у пациентов, получавших будесонид ММХ, были головная боль, тошнота. В исследованиях CORE I и II частота НЯ, возможно, связанных с ГКС (акне, задержка жидкости, гиперемия, гирсутизм, инсомния, изменение настроения, «лунное» лицо, нарушение сна, образование стрий), была сравнима с таковой для будесонида ММХ 9 мг (10,2%), 6 мг (7,5 %) и плацебо (10,5%). Самыми распространенными НЯ, возможно, связанными с ГКС, при применении будесонида ММХ 9 мг по сравнению с плацебо были изменения настроения (3,5% и 4,3% соответственно) и нарушение сна (2,7% и 4,7% соответственно). В исследовании будесонида ММХ 6 мг в течение 1 года профиль безопасности был сравним с таковым плацебо [22].
Клиническое наблюдение
Больной Б., 22 года. Болен с 2013 г., диагноз «язвенный колит» поставлен при колоноскопии в ГНЦ колопроктологии и подтвержден гистологически в 2013 г. Принимал постоянно месалазин 3 г/сут. Амбулаторно проведена колоноскопия 24.11.2014 г.: язвенный колит, тотальное поражение, минимальная активность. С января 2016 г. отменил прием препаратов 5-АСК. В феврале 2016 г. отметил появление примеси крови в стуле. Возобновил прием месалазина 3 г/сут со слабоположительным эффектом, кровь в стуле сохранялась.
Однако с середины марта 2016 г. состояние ухудшилось, кроме примеси крови в стуле отмечались диарея до 17 р./сут, периодическое повышение температуры тела до 38° С в вечернее время. При колонофиброскопии от 15.03.2016 г. колоноскоп проведен в дистальный отдел восходящей части толстой кишки, заключение: эндоскопическая картина ЯК (тотальное поражение), тяжелая степень активности (рис. 2). При ЭГДС – хронический гастродуоденит с признаками выраженного обострения процесса, дуоденогастральный рефлюкс, недостаточность кардии, Нр+. Самостоятельно увеличил дозу месалазина до 4 г/сут, микроклизмы месалазина 2 г/сут на ночь со слабоположительным эффектом в виде урежения стула до 12 р./сут, примесь крови сохранялась.
![Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006) Рис. 1. Сцинтиграфия здорового добровольца. Будесонид MMX меченый [153Sm] в толстой кишке. Изображение получено через 7 ч после приема препарата (Brunner et al., 2006)](https://www.rmj.ru/upload/medialibrary/fdc/fdce054cd022b9f2e7afc1c307ee002c.png)
18.03.2016 г. поступил на стационарное лечение в ГБУЗ МКНЦ ДЗМ. В общем анализе крови от 18.03.2016 г. отмечались лейкоцитоз (9,6 × 109) с палочкоядерным сдвигом (28%), повышение СОЭ до 26 мм/ч. В биохимическом анализе крови от 18.03.2016 г. отмечались повышение СРБ до 133,37 мг/л, латентный дефицит железа – 5,4 мкмоль/л.
При УЗИ органов брюшной полости 18.03.2016 г.: стенка левых отделов отечная, гипоэхогенная, утолщена до 7–8 мм, гаустрация сглажена, дифференциация слоев прослеживается четко не везде, в просвете – жидкость и изоэхогенное содержимое, в толще стенки – гиперэхогенные включения, что может соответствовать наличию язвенных дефектов; по ходу нисходящего отдела и сигмовидной кишки воспалительная инфильтрация параколической клетчатки с включением л/узлов размером до 11×7 мм; свободная жидкость в правой подвздошной области в небольшом количестве; заключение: эхопризнаки язвенного колита, левостороннее поражение, воспалительная инфильтрация параколической клетчатки по ходу левых отделов ободочной кишки с лимфаденопатией, небольшое количество свободной жидкости в правой подвздошной области (рис. 3). Кальпротектин кала от 19.03.2016 г. – 840 мкг/г.
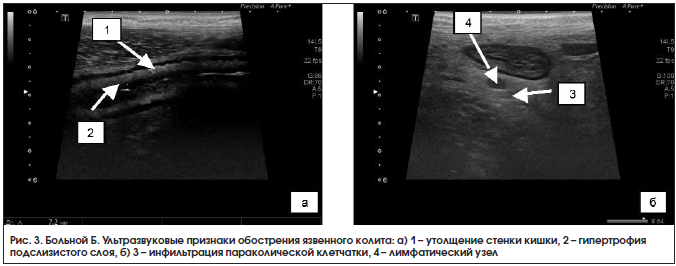
Установлен диагноз: язвенный колит, тотальное поражение, хроническое рецидивирующее течение, средней степени тяжести, умеренной активности. Латентный дефицит железа.
С учетом отсутствия у больного эффекта от терапии препаратами 5-АСК и категорического отказа от проведения терапии системными ГКС больному назначены Кортимент (топические ГКС) 9 мг/сут, месалазин 5 г/сут, микроклизмы с гидрокортизоном 125 мг 2 р./сут, метронидазол 500 мг 3 р./сут в/в, гидроксид железа 100 мг/сут № 3; цефтриаксон 2,0 г/сут в/в капельно.
На фоне терапии через 10 дней у больного отмечалось улучшение состояния в виде урежения стула до 2 р./сут, без примеси слизи и крови.
При контрольном УЗИ кишечника 28.03.2016 г.: по сравнению с предыдущим исследованием от 18.03.2016 г. отмечается положительная динамика. Тонкая кишка: петли не расширены, прослеживается ритмичная перистальтика, содержимое – средней эхогенности. Осмотрена ободочная кишка. В проекции слепой кишки, восходящего и поперечного отдела стенки не утолщены (2 мм), дифференциация слоев четкая. В проекции нисходящего отдела и сигмовидной кишки стенки толщиной 2,5–2,7 мм, слоистость стенки сохранена, более выражен подслизистый слой, в толще стенки сохраняются гиперэхогенные включения до 1,5 мм (вероятно, язвы). Клетчатка вокруг умеренно повышенной эхогенности с включением л/узлов размером до 8×3 мм. В правой подвздошной области межпетельно незначительное количество свободной жидкости. Заключение: эхопризнаки язвенного колита, левостороннее поражение, обострение. Мезентериальная лимфаденопатия (рис. 4). В общем анализе крови от 28.03.2016 г. сохраняется повышение СОЭ до 33 мм/ч. В биохимическом анализе крови от 28.03.2016 г. – нормализация уровня СРБ до 3,25 мг/л.
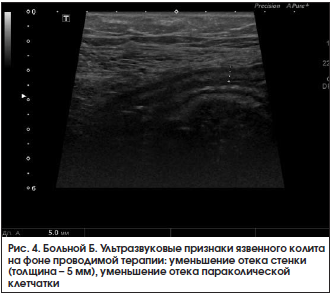
Заключение
Лекарственная формула будесонид ММХ доставляет лекарственное вещество в толстую кишку на всем ее протяжении [23], в то время как другие пероральные формы будесонида с контролируемым высвобождением работают только в дистальной части подвздошной кишки и в восходящей кишке – участках, которые наиболее часто поражаются воспалительным процессом при БК [24].
Будесонид ММХ является эффективным и хорошо переносится при применении с целью индукции ремиссии у пациентов с ЯК легкой и средней тяжести. Имеющиеся в настоящее время данные говорят о том, что этот препарат может быть эффективным и хорошо переноситься для поддержания длительной ремиссии (более 1 года) у пациентов с ЯК [17, 18]. Долгосрочная безопасность ММХ будесонида у пациентов с ЯК сравнима с таковой плацебо, эти данные представлены только в одном исследовании, которое длилось 12 мес. [19]. Однако в нескольких исследованиях изучали применение пероральных форм будесонида в качестве поддерживающей терапии у пациентов с БК, и это подтверждает долгосрочную (до 1 года) безопасность будесонида при поддержании ремиссии ВЗК [25–32]. Применение будесонида ММХ также может быть полезным в фармакоэкономическом плане в связи с возможным повышением приверженности терапии благодаря однократному приему препарата и снижению риска побочных явлений по сравнению с таковым при приеме традиционных пероральных кортикостероидов. Однако необходимо дальнейшее изучение этого препарата у пациентов с ВЗК.
Источник



