Оценка напряженности иммунитета к кори
В статье представлены результаты исследования, посвященного анализу напряженности популяционного иммунитета к вирусу кори, краснухи, эпидемического паротита и ветряной оспы у взрослых.
Введение
Антропонозные вирусные инфекции с аэрозольным механизмом передачи составляют большую группу заболеваний в инфекционной патологии. К ним относят такие инфекции, как корь, краснуха, эпидемический паротит и ветряная оспа. Издавна они считаются детскими инфекциями и инфекциями организованных коллективов. В настоящее время отмечается их «повзросление», они все чаще встречаются среди взрослого населения. Этими инфекциями болеют повсеместно на всей территории Российской Федерации и дети, и взрослые.
Начиная с 1994 г. наблюдалось снижение заболеваемости корью. В 2005–2012 гг. уровень заболеваемости корью на территории России не превышал 1 случай на 100 тыс. населения. Однако в 2012 г. отмечен подъем заболеваемости кори как в Европейском регионе, так и на территории Российской Федерации. Подъем заболеваемости достиг пика в 2014 г. (3,23 на 100 тыс. населения). К 2016 г. показатели заболеваемости снизились и составили 0,12 на 100 тыс. населения. В 2017 г. на территории Российской Федерации зарегистрировано 725 случаев кори. Заболеваемость совокупного населения корью в России в 2017 г. составила 0,50 на 100 тыс. населения. Заболеваемость детского населения до 17 лет составила 1,63 на 100 тыс. населения (в 2016 г. — 0,35 на 100 тыс.). Заболеваемость корью на территории России в 2018 г. возросла в 4,5 раза по сравнению с аналогичным периодом предыдущего года. Наиболее высокая заболеваемость отмечалась среди детей раннего возраста, в возрастной группе 1–2 года — 4,9 на 100 тыс. детей данного возраста (189 случаев) [1].
Ситуация по кори в мире и в странах Европы остается неблагополучной. В 2017 г. отмечен многократный рост заболеваемости в Европейском регионе. Так, в январе 2017 г. в европейских странах (Германия, Италия, Польша, Румыния, Франция, Швейцария) зарегистрировано 474 случая кори. Кроме того, крупные вспышки кори зарегистрированы в Италии и Румынии [1, 2]. Учитывая усилия, предпринимающиеся по ликвидации кори согласно программе ВОЗ, ситуацию нельзя считать благополучной. Одним из основных мероприятий по профилактике кори является вакцинация с применением живой коревой вакцины (первая вакцинация в возрасте 12 мес., ревакцинация в 6–7 лет). Подлежат вакцинации дети от 1 года до 18 лет (включительно) и взрослые до 35 лет (включительно), неболевшие, непривитые, привитые однократно, а также не имеющие сведений о прививках против кори. Лица, которые относятся к группам риска, подлежат вакцинации до 55 лет. По рекомендациям ВОЗ охват прививками населения должен составлять более 95% от вакциноуправляемых инфекций [3, 4].
Ветряная оспа — самая распространенная детская инфекция и по количеству случаев уступает лишь острым респираторным инфекциям. Ветряная оспа вызывается вирусом Varicella zoster (VZV), который относится к типу 3 вирусов герпеса и вызывает два заболевания: ветряную оспу и опоясывающий герпес. После перенесенной в детстве инфекции в ганглиях задних корешков спинного мозга формируется пожизненное носительство вируса в дремлющем состоянии. В момент ослабления клеточного звена иммунной системы под влиянием факторов внешней среды, психоэмоциональной перегрузки происходит реактивация вируса, которая клинически проявляется в виде опоясывающего герпеса. Кроме того, ветряная оспа может представлять опасность для лиц, составляющих группу риска (беременные, недоношенные и маловесные дети со стойкими иммунологическими дефектами, а также лица с ВИЧ-инфекцией). Дети с онкологическими заболеваниями наиболее предрасположены к заболеванию ветряной оспой [5, 6]. Показатель заболеваемости ветряной оспой на территории России в 2017 г. составил 585,21 на 100 тыс. населения (в 2016 г. — 544,59 на 100 тыс. населения). Среди детского населения в 2017 г. зарегистрировано 2831,61 случая на 100 тыс. населения (в 2016 г. — 2673,31 на 100 тыс.). Показатель заболеваемости ветряной оспой среди взрослого и детского населения в 2017 г. на территории России увеличился на 7,7% и 5,9% соответственно. За 2017 г. было зарегистрировано 4 случая смерти от ветряной оспы, из них 3 случая — дети [7].
Показатель заболеваемости эпидемическим паротитом в 2017 г. составил 3,03 на 100 тыс. населения. По сравнению с 2016 г. (0,76 на 100 тыс. населения) заболеваемость возросла в 4 раза. Среди детского населения (возраст до 17 лет) заболеваемость эпидемическим паротитом увеличилась в 3,3 раза. Эпидемический паротит распространен повсеместно. К данному заболеванию восприимчивы как дети, так и взрослые. Вирус поражает околоушные железы. По данным литературы, у 61,9% больных отмечается двустороннее поражение желез. Тяжелое течение заболевания может привести к таким осложнениям, как орхит, панкреатит и менингит. Кроме того, перенесенный в детстве паротит может вызвать развитие сахарного диабета [5, 8].
На данный период времени эпидемическая обстановка по краснухе благоприятная. В 2017 г. было зарегистрировано пять случаев краснухи среди совокупного населения России. Синдрома врожденной краснухи на территории России не зарегистрировано.
Единственным эффективным средством профилактики против кори, краснухи, эпидемического паротита и ветряной оспы является вакцинация как детей, так и взрослых. Вакцинация против кори, краснухи и эпидемического паротита внесена в национальный календарь профилактических прививок. В соответствии с приказом Минздрава России от 21 марта 2014 г. № 125н «Об утверждении национального календаря профилактических прививок и календаря прививок по эпидемическим показаниям» вакцинация против ветряной оспы проводится только по эпидемическим показаниям. В 2009 г. вакцинация против ветряной оспы внесена в региональный календарь прививок г. Москвы и Свердловской области.
Вирусные инфекции, особенно вовлекающие в патологический процесс кожу, могут послужить триггером для запуска или фактором обострения аллергопатологии, тогда как вовремя и правильно проведенная вакцинация живыми вирусными вакцинами практически не дает таких последствий [9].
Цель исследования: проанализировать напряженность популяционного иммунитета к вирусу кори, краснухи, эпидемического паротита и ветряной оспы на примере 93 здоровых взрослых в возрасте 18–30 лет.
Материал и методы
Материалом для исследования напряженности иммунитета против кори, краснухи, эпидемического паротита и ветряной оспы послужила сыворотка крови 93 случайно выбранных условно здоровых человек в возрасте 18–30 лет. Дополнительно у всех был собран прививочный анамнез.
Сведения о вакцинации получены из личных медицинских книжек. Так, у 61 человека не было сведений о прививках против кори, у 29 — такие сведения имелись, из них у 21 — прививка проводилась в возрасте 6–7 лет, у 4 — в возрасте 1 года. У 3 человек было лишь указано, что они привиты по возрасту от кори, но без указания даты вакцинации.
У 66 человек прививочный статус в отношении краснухи был неизвестен. У 27 человек такие сведения имелись, из них у 12 — о вакцинации в возрасте 11–12 лет, у 7 — о вакцинации по возрасту без указания даты.
У 65 обследованных прививочный статус относительно эпидемического паротита был неизвестен. У 28 человек такие сведения имелись, из них у 4 — сведения о первой прививке в возрасте 1 года, у 15 — в возрасте 6–7 лет и только у 7 — о прививках по возрасту без указания даты.
Относительно ветряной оспы у 83 человек прививочный статус был неизвестен. У 10 человек такие сведения имелись, из них у 5 — сведения о вакцинации в возрасте от 3 до 5 лет. Один человек привит в возрасте 14 лет, и 4 человека привиты по возрасту без указания даты вакцинации.
Забор крови осуществляли из локтевой вены в количестве 4 мл. Сыворотку крови, полученную для определения специфического иммунитета, разливали в пробирки типа «эппендорф», замораживали и хранили до использования при температуре -70 °С. Специфические иммуноглобулины класса G (IgG) к антигенам вирусов кори, краснухи, эпидемического паротита и ветряной оспы в сыворотке крови определяли методом иммуноферментного анализа (ИФА) с помощью тест-систем (Россия) в соответствии с прилагаемой инструкцией производителя. Защитным уровнем IgG для кори считали показатель 0,2 МЕ/мл, для краснухи — 25 МЕ/мл [10]. Для оценки уровня специфических антител к вирусам эпидемического паротита и ветряной оспы рассчитывали коэффициент позитивности, равный отношению полученного для каждой сыворотки значения в единицах оптической плотности к уровню cut off.
Полученные результаты были подвергнуты статистической обработке с вычислением медианы, первого и третьего квартиля (пакет статистических программ Microsoft Office Excel 2010).
Результаты и обсуждение
По результатам ИФА получили процентное выражение защищенности в зависимости от уровня специфических IgG к антигенам вирусов кори, краснухи, эпидемического паротита и ветряной оспы, которое представлено на рисунке 1.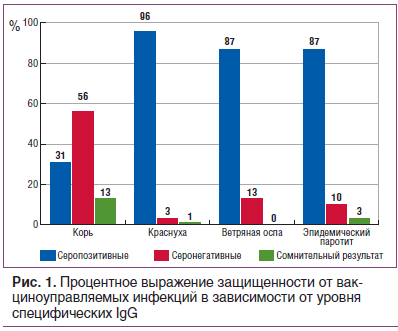
Специфические IgG к вирусу ветряной оспы были обнаружены у 87% обследованных, что может свидетельствовать о перенесенной инфекции в раннем возрасте. Кроме того, отмечен высокий уровень защиты против краснухи — 96% и эпидемического паротита — 87%, что свидетельствует о наличии специфического иммунитета в результате вакцинации или перенесенной инфекции. У 43% обследованных отмечены высокие уровни антител к вирусу краснухи, что может говорить о перенесенной ранее инфекции (у данных пациентов уровень антител был 300 Ме/мл и выше, что возникает именно в случае перенесенной инфекции). В таблице 1 представлены средние уровни противовирусных антител к вирусам рассматриваемых инфекций. Средний уровень антител к вирусу краснухи, эпидемического паротита и ветряной оспы в индикаторной группе (18–30 лет) превышает защитный уровень. Критерием эпидемиологического благополучия по краснухе считается выявление в обследованной группе не более 7% серонегативных лиц, для эпидемического паротита — 5%. Доля восприимчивых к инфекции краснухи составила 3%, к паротиту — 10%, что соответствует критериям эпидемиологического благополучия по данным инфекциям.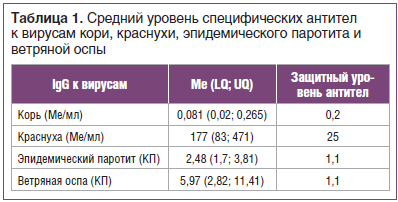
По полученным результатам можно сказать, что обследованная группа имеет низкую восприимчивость к вирусу краснухи и вирусу эпидемического паротита. Аналогичные результаты получены в отношении вируса ветряной оспы (13% серонегативных) преимущественно за счет перенесенного заболевания, т. к. только 10 человек из обследованной группы были привиты против ветряной оспы.
Другая ситуация складывается с корью: доля серонегативных составила 56% (52 человека) из 93 обследованных. Следы специфических антител (но ниже защитного уровня) имели 13% из обследованных. И лишь 31% имели защитные уровни в результате вакцинации. Один человек был выявлен с титром антител 2,10 МЕ/мл, что может свидетельствовать о перенесенной инфекции. Средний уровень противокоревых антител оказался ниже защитного уровня. Критерием эпидемического благополучия по кори считается выявление в обследуемой группе не более 7% серонегативных лиц. В нашем случае 69% обследованных оказались не защищенными от вируса кори. Таким образом, эти лица составляют группу высокого риска инфицирования и распространения инфекции кори.
При анализе прививочного статуса было выявлено, что у большинства обследованных отсутствовали сведения о прививках. Причины этого могут быть различными: небрежное оформление документов и утеря медицинских документов, отказ от прививок, медицинские отводы. Часть обследованных имеют сведения о вакцинации, но по результатам серологического мониторинга титр специфических антител IgG у них ниже защитного уровня. Причинами этого несоответствия могут быть нарушение «холодовой цепи» в пути транспортировки вакцины от изготовителя до вакцинируемого или нарушение сроков вакцинации. Такие люди считаются привитыми, но не имеют защитного титра.
Заключение
С 2011 г. отмечается рост заболеваемости корью в Российской Федерации, одна из причин ухудшения ситуации — накопление в популяции восприимчивых (неиммунных) лиц на фоне выраженной миграции населения. Одним из достоверных методов оценки иммунной прослойки населения является серомониторинг (определение IgG у здоровых лиц). Результаты серологических исследований показывают, был ли человек привит, или не привит, или перенес инфекцию ранее. Такой метод дает достоверный материал для анализа напряженности коллективного иммунитета на популяционном уровне, кроме того, позволяет прогнозировать дальнейшую эпидемическую ситуацию в стране [10, 11]. На сегодня растет количество отказов родителей от профилактических прививок. По данным проведенных исследований выявлено, что лишь 80% детей привиты в возрасте до 2 лет [3]. Правильно и вовремя сделанная прививка живыми вирусными вакцинами не вызывает обострения имеющейся аллергопатологии и не провоцирует формирование новой [9]. В то же время вирусные инфекции, вовлекающие в воспалительный процесс кожу и респираторный тракт, могут послужить как фактором обострения аллергопатологии, так и непосредственным триггером, запускающим аллергический процесс. Необходимо повышать информированность родителей по вопросам вакцинопрофилактики путем проведения разъяснительных работ, а медицинского персонала — путем образовательных семинаров и лекций.
Источник
Корь – высококонтагиозное антропонозное острое инфекционное заболевание с воздушно-капельным путем передачи. Возбудитель кори – РНК содержащий вирус (семейство Paramyxoviridae, род Morbillivirus). Только 1% восприимчивых лиц не заболевает корью при первом тесном контакте с больным.
Корь начинается с продромального периода, для которого характерны повышение температуры тела до 38°С и выше, кашель, насморк, чихание, покраснение глаз и светобоязнь, энантема в полости рта (пятна Филатова-Коплика). С 4-5 дня болезни наблюдается поэтапное высыпание пятнисто-папулезной сыпи (на первый день сыпь появляется на лице и шее, на второй день – на туловище, на третий день – на ногах и руках), на месте сыпи остается пигментация и отрубевидное шелушение. Инкубационный период длится в среднем около 10 дней (от 7 до 18 дней) с момента инфицирования дыхательных путей и до повышения температуры.
Несмотря на наличие доступных высокоиммуногенных вакцин, корь все еще остается одной из основных причин детской смертности в развивающихся странах и периодически приводит к возникновению крупных вспышек в индустриально развитых странах. В 2010-2011 годах крупные вспышки кори были зарегистрированы в ряде стран Африки, Юго-Восточной Азии и Европы (Франция, Германия, Болгария, Румыния). Особенно тревожная ситуация сложилась в 2012 году на Украине, где за три месяца заболело более 10000 человек. В Российской Федерации, большинство административных территорий которой в январе 2011 года были сертифицированы на отсутствие эндемичной кори, ситуация осложнилась в 2011-2012 годах в Южном и Северокавказском Федеральных округах, в Москве, Санкт-Петербурге и ряде других городов.
Вирус кори присутствует в крови, носоглоточных выделениях и моче во время продромального периода и в течение 3-4 дней с момента появления сыпи. АТ к вирусу кори впервые можно обнаружить в крови с момента появления сыпи. Максимальный уровень содержания АТ IgM в крови приходится на 4-7 дни после появления сыпи, они сохраняются в течение 28 дней, в редких случаях их можно обнаружить спустя 8 недель с момента появлении сыпи. АТ IgG начинают вырабатываться с момента появления сыпи и достигают максимального уровня через 2 недели; их можно выявить в течение долгих лет после перенесенной инфекции.
Показания к обследованию. Больные с диагнозом «корь», «корь ?» и с другими клиническими диагнозами, имеющие пятнисто-папулезную сыпь и температуру тела 37,5°С и выше.
Дифференциальная диагностика. Заболевания, протекающие с мелкопятнистой экзантемой (краснуха, скарлатина, инфекционный мононуклеоз, лекарственные и аллергические экзантемы, протекающие с повышением температуры тела).
Этиологическая лабораторная диагностика включает выделение вируса кори, выявление РНК вируса кори, обнаружение АТ к вирусу кори.
Материал для исследования
- Сыворотка крови – выявление АТ;
- моча, назофарингиальные смывы, лимфоциты периферической крови – выделение вируса кори;
- мазки из носоглотки и ротоглотки – выявление РНК вируса.
Сравнительная характеристика методов лабораторной диагностики. Лабораторная диагностика коревой инфекции в рамках Программы элиминации кори в РФ проводится только в вирусологических лабораториях Региональных центров по эпидемиологическому надзору за корью с помощью тест-систем, рекомендованных ВОЗ. Для лабораторной диагностики кори применяют главным образом выявление АТ к вирусу (серологическая диагностика). Для диагностики кори используют как обнаружение АТ отдельных классов (IgM и IgG), так и количественное определение специфических АТ в крови для установления их значимого прироста при одновременном исследовании двух проб, полученных от больного в остром периоде и в период реконвалесценции (парные сыворотки).
Для выявления вирусоспецифических АТ IgM и IgG в настоящее время используется преимущественно метод ИФА. Благодаря высокой чувствительности и специфичности, простоте и скорости выполнения, возможности автоматизации исследования, метод доступен любой лаборатории. Для получения корректных результатов и облегчения их интерпретации большое значение имеет правильно выбранное по отношению к появлению клинических симптомов кори время забора образца.
Для выявления изменения уровня суммарных АТ с использованием реакции нейтрализации (РН) цитопатического действия вируса кори, требуется наличие двух образцов сыворотки крови, взятых у больного в остром периоде заболевания и на стадии реконвалесценции. Метод обладает 100% чувствительностью по отношению к клинически подтвержденным случаям. Этот тест не является легким в применении, потому что он требует наличия высококвалифицированного персонала, имеющего опыт работы с культурами клеток. Результаты анализа могут быть получены через 10 дней после получения сыворотки реконвалесцента.
Оценка изменения содержания специфических АТ с использованием метода РТГА также требует наличия двух образцов сыворотки крови, полученных у больного в остром периоде и на стадии реконвалесценции. У вакцинированных лиц метод демонстрирует 98% чувствительность. Этот тест также не является легким в применении, потому что требует высококвалифицированного персонала, а также наличие свежих эритроцитов обезьян. Результаты анализа могут быть получены через 2 дня после получения сыворотки реконвалесцента.
Выделение вируса кори выполняют на культуре клеток Vero. Обнаружение и идентификация вируса кори на культуре клеток может занять несколько недель, поэтому не рекомендуется использовать этот метод для первичной диагностики инфекции, изоляция вируса кори проводится в специализированных лабораториях.
Выявление РНК вируса методом ПЦР с обратной транскрипцией не получило пока широкого распространения. Секвенирование генома вируса кори применяется в целях определения генотипа возбудителя кори. Генетический анализ позволяет сравнивать штаммы, полученные из различных мест в разные годы, что позволяет получить информацию о происхождении вирусов и проследить пути их передачи.
Показания к применению различных лабораторных исследований. Для диагностики кори ВОЗ рекомендует использовать обнаружение вирус-специфических IgM методом ИФА в образце сыворотки крови, взятом после четвертого дня от момента появления сыпи. Взятие крови для исследований осуществляется на 4-7 день с момента появления сыпи.
При выявлении АТ IgМ к вирусу кори у пациентов с лихорадкой и пятнистопапулезной сыпью, обследуемых в рамках активного эпидемиологического надзора за корью, дополнительно проводится исследование для выявления АТ IgG методом ИФА в «парных сыворотках». Взятие крови для исследований осуществляется на 4-7 день с момента появления сыпи (1-я сыворотка) и не ранее чем через 10-14 дней от даты взятия первой пробы (2-я сыворотка).
Для определения напряженности иммунитета к вирусу кори ВОЗ рекомендует применять выявление АТ IgG в сыворотке крови методом ИФА.
Для выявления вируса кори и его РНК используют биоматериалы, взятые в продромальный период заболевания и в первые три дня после появления сыпи. При взятии образцов следует учитывать, что интенсивность экскреции вируса быстро падает.
Особенности интерпретации результатов лабораторных исследований. Вирусоспецифические АТ IgM появляются в течение первых дней с момента высыпания, спустя месяц их уровень начинает быстро снижаться. Их наличие в крови пациента достоверно свидетельствует об острой свежей инфекции. АТ IgM также вырабатываются при первичной вакцинации и, хотя их уровень снижается быстрее, чем уровень АТ IgM, вырабатывающихся в ответ на инфицирование диким вирусом, специфические АТ IgM к дикому или вакцинному вирусу не могут быть разделены используемыми в рутинной диагностике методами. В этом случае для интерпретации полученных результатов следует обратиться к истории вакцинации конкретного пациента.
Поскольку исследование АТ IgM методом ИФА обладает максимальной чувствительностью между 4-м и 28-м днями от момента появления сыпи, то исследование образца крови, полученного в эти сроки, считается адекватным для диагностики кори. Повторное взятие образца крови может понадобиться в случае отрицательного результата выявления АТ IgM в первом образце крови, полученном в течение первых трех дней от момента появления сыпи. Повторное взятие крови для выявления АТ IgG выполняют через 10-14 дней после взятия первого. Нарастание титра специфических АТ IgG в 4 и более раза при одновременном исследовании обеих проб с использованием стандартных тестов является основанием для постановки диагноза «корь».
Источник


