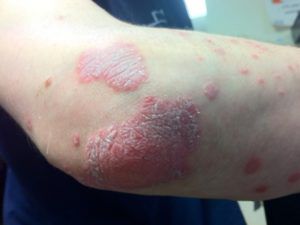
Особенности иммунитета при кандидозе
Кандидоз и иммунитет тесно связаны между собой. Именно понижение защитных функций организма чаще всего приводит к первому появлению и дальнейшим рецидивам молочницы. Поэтому укрепление иммунитета является неотъемлемой частью лечения кандидоза.
Особенности
Это заболевание появляется вследствие чрезмерного количества дрожжеподобных грибов Candida, определенная часть которых всегда находится в половых органах. Вредные свойства этих грибков проявляются после воздействия на них следующих факторов:
- смещение уровня pH в сторону кислой среды,
- ухудшение адгезии для другой микрофлоры,
- стимуляция иммунитета.
Слизистая оболочка влагалища женщины теряет свою защитную функцию при нарушении общего иммунитета организма. Это явление может наблюдаться вследствие хронических инфекционных болезней, дисбактериоза ЖКТ, патологий эндокринной системы или недостатка витаминов. Кроме того, нарушению иммунитета способствуют вредные привычки — курение и чрезмерное употребление спиртного.
Улучшить иммунитет при кандидозе можно при помощи здорового питания и умеренных физических нагрузок. Не стоит списывать со счетов и народные средства. Вы также можете обратиться к врачу, который пропишет иммуномодулирующие медикаменты и специальные витамины, позволяющие значительно повысить сопротивляемость организма.
Народные средства
Если вы решили воспользоваться народной медициной для повышения иммунитета при молочнице, следует запастись терпением, так как выбранное средство нужно будет принимать достаточно долго. Народные средства дают наилучшие результаты в сочетании с препаратами традиционной медицины.
Для улучшения сопротивляемости организма можно использовать следующие рецепты:
- Сушеные листья смородины настаивать в кипятке около 15 минут, после чего недолго подержать настойку на малом огне. В получившуюся смесь добавляются измельченные зубцы чеснока, затем настойка перемешивается и кипятится еще 2 минуты. Состав нужно охладить, после чего туда необходимо добавить сок целого лимона.
- Необходимо взять 3 средних луковицы, 5 ст. л. меда, 1 лимон и 1 апельсин. Все эти составляющие нужно перемешать между собой, предварительно измельчив твердые фрукты и овощи. Смесь принимается внутрь 3 раза в сутки в течение 30 дней.

Витамины и иммуномодуляторы
Если молочница постоянно возвращается из-за пониженной сопротивляемости организма, пациентам прописываются витамины и иммуномодуляторы. Назначать такие средства может только врач исходя из общей картины заболевания и особенностей организма пациента.
При кандидозе обычно прописываются витамины групп A, C и E, так как они являются хорошими антиоксидантами и способны восстанавливать слизистые оболочки. Важно обеспечить и достаточное количество витаминов B, потому что они во многом определяют уровень общего иммунитета. Конечно, лучше всего получать эти полезные вещества из пищи, но когда их количества недостаточно для повышения иммунитета, используются специальные медикаменты.
Как правило, витаминные комплексы содержат в себе микроэлементы, которые способствуют усваиванию соответствующих витаминов.
Иммуностимуляторы прописываются, когда развивается вторичный иммунодефицит, который сопровождается постоянными рецидивами кандидоза. Самостоятельное лечение такими средствами недопустимо.
Питание и физические нагрузки
Изменение рациона играет очень важную роль в повышении иммунитета. В первую очередь нужно увеличить количество приемов пищи до 5 и уменьшить размеры порций.
Для улучшения сопротивляемости организма нужно каждый день употреблять овощи и фрукты, которые содержат большое количество клетчатки. В сочетании с кисломолочными продуктами пищевые волокна восстанавливают микрофлору ЖКТ, которая поддерживает местный и общий иммунитет. Кроме того, будет полезно есть цитрусовые, сухофрукты, орехи, морскую рыбу, зелень и другие полезные продукты.
При кандидозе следует отказаться от продуктов, содержащих сахар, так как именно им питается Candida. Следует ограничить употребление и “хороших” сахаров: меда, сиропов и подсластителей. Не стоит увлекаться и жирными блюдами, выпечкой, острыми продуктами и сильногазированными напитками, которые отрицательно влияют на микрофлору кишечника.
Не стоит забывать и о жидкости, ведь каждому человеку в день нужно выпивать до 2 л воды. Особое внимание стоит уделить качеству жидкости.
Лучше всего пить минеральную воду низкой минерализации, зеленые чаи, напиток с медом и лимоном, отвары целебных трав и т. д.
Прибегая к физическим упражнениям, очень важно не перестараться и соблюдать перерывы между нагрузкой и отдыхом. Необходимо регулярно выполнять простые общеукрепляющие упражнения с частотой 3-4 раза в неделю. Это позволит укрепить органы дыхания и сердечно-сосудистую систему организма. Кроме того, улучшится общий кровоток, что благотворно скажется на состоянии иммунитета. Если соблюдать регулярность тренировок, можно сделать организм более стойким к негативному воздействию стрессов, которые часто вызывают рецидивы кандидоза.
Загрузка…
Источник
Èììóíèòåò ïðè êàíäèäîçå
À . Þ. Ñåðãååâ
Èíñòèòóò àëëåðãîëîãèè è êëèíè÷åñêîé èììóíîëîãèè, Ìîñêâà
(Îêîí÷àíèå)
[Ïðåäûäóùàÿ ñòðàíèöà] [ íà÷àëî…]
Êîìïëåìåíò
Ðîëü êîìïëåìåíòà â çàùèòå ìàêðîîðãàíèçìà ïðè ãëóáîêîì êàíäèäîçå ïðåäñòàâëÿåòñÿ íåñîìíåííîé. Îäíàêî êîíêðåòíûå ìåõàíèçìû äåéñòâèÿ êîìïëåìåíòàðíîé ñèñòåìû è èõ âçàèìîäåéñòâèå ìåæäó ñîáîé è äðóãèìè ôàêòîðàìè èììóíèòåòà îñòàþòñÿ íå óòî÷íåííûìè.
Âîîáùå, ðîëü êîìïëåìåíòà çàêëþ÷àåòñÿ â ñâÿçûâàíèè (ïðÿìîì ïî àëüòåðíàòèâíîìó ïóòè è îïîñðåäîâàííîì àíòèòåëàìè ïî êëàññè÷åñêîìó ïóòè) ñ îïñîíèçàöèåé èëè íåïîñðåäñòâåííûì óíè÷òîæåíèåì ìèêðîáîâ, à òàêæå â îáðàçîâàíèè ôàêòîðîâ, îáåñïå÷èâàþùèõ õåìîòàêñèñ ôàãîöèòîâ.
Àíòèòåëà êëàññà IgG ê ìàííàíîâûì àíòèãåíàì ñïîñîáíû çàïóñêàòü àêòèâàöèþ ôàêòîðà Ñ3 ïî êëàññè÷åñêîìó ïóòè (73). Êðîìå òîãî, ñûâîðîòî÷íûé ìàííîçîñâÿçûâàþùèé áåëîê (MBP) ìîæåò ñïîñîáñòâîâàòü àêòèâàöèè êëàññè÷åñêîãî ïóòè, âçàèìîäåéñòâóÿ ñ ìàííàíîì êëåòî÷íîé ñòåíêè. Íåñêîëüêèìè èññëåäîâàíèÿìè áûëà äîêàçàíà ñïîñîáíîñòü ðàçíûõ Candida spp. ê àêòèâàöèè àëüòåðíàòèâíîãî ïóòè êîìïëåìåíòà(66,34). Ïðè ýòîì øòàììû C. albicans, â îòëè÷èå îò îñòàëüíûõ âèäîâ Candida, îêàçûâàþòñÿ íåñïîñîáíûìè ñâÿçûâàòü Ñ3b ôàêòîð, íî ñâÿçûâàþò C3d è iC3b(25). Ôàêòîð Ñ3b íåîáõîäèì äëÿ îïñîíèçàöèè è çàïóñêà òåðìèíàëüíîãî ïóòè êîìïëåìåíòà, ïðèâîäÿùåãî ê ëèçèñó ìèêðîáîâ. Îòñóòñòâèå ñâÿçûâàíèÿ ñ Ñ3b ìîæåò îçíà÷àòü íåñïîñîáíîñòü êîìïëåìåíòà ê ïðÿìîìó ëèçèñó C. albicans.
Îïñîíèçàöèÿ êëåòîê C. albicans ñ èõ ïîñëåäóþùèì çàõâàòîì ìîæåò áûòü îáåñïå÷åíà òîëüêî ôàêòîðîì iC3b, ðåöåïòîðû ê êîòîðîìó (ÑD11 èëè CR3) èìåþòñÿ ó ìàêðîôàãîâ, íåéòðîôèëîâ è NK êëåòîê. Îäíàêî ñîáñòâåííûé ðåöåïòîð òèïà CR3 ó C. albicans ìîæåò çàíèìàòü öåíòð ñâÿçûâàíèÿ iC3b è ïðåïÿòñòâîâàòü îïñîíèçàöèè (21). Ñâÿçü êàíäèäíîãî ðåöåïòîðà ñ iC3b ïðè òåìïåðàòóðå òåëà ÷åëîâåêà è ãèïåðòåðìèè îñëàáëÿåòñÿ (15).
Ïî-âèäèìîìó, CR3 ðåöåïòîð êëåòîê ÷åëîâåêà íå ÿâëÿåòñÿ íåîáõîäèìûì äëÿ óñïåøíîé ýëèìèíàöèè îïñîíèçèðîâàííûõ êëåòîê C. albicans.  åãî îòñóòñòâèå çàõâàò äðîææåâûõ êëåòîê îáåñïå÷èâàåòñÿ äðóãèìè ðåöåïòîðàìè (41).
Õåìîòàêòè÷åñêèå ôàêòîðû C3à è Ñ5à ñîõðàíÿþò ñâîå çíà÷åíèå ïðè êàíäèäîçå, èãðàÿ òó æå ðîëü, ÷òî è ïðè äðóãèõ èíôåêöèÿõ. Ïîñêîëüêó ýôôåêòèâíîñòü ôàãîöèòîçà — conditio sine qua non äëÿ ïîáåäû ìàêðîîðãàíèçìà íàä ãëóáîêîé êàíäèäíîé èíôåêöèåé, ïîëíîöåííûé õåìîòàêñèñ ôàãîöèòîâ íåîáõîäèì.  ýêñïåðèìåíòå äîêàçàíî ñíèæåíèå ñîïðîòèâëÿåìîñòè è ÷àñòûå ëåòàëüíûå èñõîäû ïðè ãëóáîêîì êàíäèäîçå ó æèâîòíûõ, ëèøåííûõ ôàêòîðà C5(1).
Âçàèìîäåéñòâèå ðàçíûõ êîìïîíåíòîâ èììóííîé ñèñòåìû ïîêàçàíî íà ðèñ. 1.
| Ðèñ. 1 Âçàèìîäåéñòâèå è ðåãóëÿöèÿ èììóííîãî îòâåòà ïðè êàíäèäîçå. Mj: ìàêðîôàãè, ÏßË: ïîëèìîðôíî-ÿäåðíûå ëåéêîöèòû, Â: Â-ëèìôîöèòû, NK/LAK: åñòåñòâåííûå êèëëåðû è ëèìôîöèò-àêòèâèðîâàíûå êèëëåðû; gd +: Ò ëèìôîöèòû, íåñóùèå gd -ðåöåïòîðû |
Çàùèòà Candida spp. îò âîçäåéñòâèÿ ìàêðîîðãàíèçìà
Íåñìîòðÿ íà àãðåññèâíîå âëèÿíèå ñëîæíîé ìíîãîóðîâíåâîé ñèñòåìû çàùèòû ìàêðîîðãàíèçìà, ãðèáàì Candida spp. íåðåäêî óäàåòñÿ ïðîòèâîñòîÿòü ýòîìó âëèÿíèþ è óñïåøíî âûçûâàòü èíôåêöèþ. Çäåñü áîëüøå âñåõ ïðåóñïåâàåò âèä C. albicans, âî ìíîãîì áëàãîäàðÿ ñâîåé èçìåí÷èâîñòè è øèðîêèì àäàïòàöèîííûì ñïîñîáíîñòÿì. Ñìåíà ôàç ðîñòà, ñóùåñòâîâàíèå ïðè ðàçíûõ òåìïåðàòó-
ðå è êèñëîòíîñòè, ïåðåêëþ÷åíèå ôåíîòèïîâ ïîçâîëÿþò C. albicans è íåêîòîðûì äðóãèì âèäàì Candida ïðèñïîñàáëèâàòüñÿ ê âîçäåéñòâèþ åñòåñòâåííûõ çàùèòíûõ ôàêòîðîâ.
Äèíàìè÷åñêàÿ ñòðóêòóðà êëåòî÷íîé ñòåíêè è ïðîòåèíàçû ïîçâîëÿþò ãðèáàì èçáåãàòü ìíîæåñòâà ñåêðåòèðóåìûõ ïðîòèâîìèêðîáíûõ âåùåñòâ, à òàêæå ïðîòèâîñòîÿòü êîíêóðåíöèè áàêòåðèàëüíîé ìèêðîôëîðû. Ïðîòåèíàçû ñïîñîáíû ðàñùåïëÿòü ñåêðåòèðóåìûå èììóíîãëîáóëèíû è ôàêòîðû êîìïëåìåíòà. Ñîáñòâåííûå ðåöåïòîðû iC3b è C3d è îòñóòñòâèå ðåöåïòîðà ê C3b ïîçâîëÿþò C. albicans îáìàíûâàòü ñèñòåìó êîìïëåìåíòà, îáåñöåíèâàÿ åå äåéñòâèå. Ïðè ïîãëîùåíèè C. albicans ôàãîöèòàìè ãðèáêîâûå êëåòêè ïðîòèâîñòîÿò íåîêèñëèòåëüíûì ìåõàíèçìàì ñ ïîìîùüþ ïðîòåèíàç. Êðîìå òîãî, C. albicans èìååò ôåðìåíò êàòàëàçó, êîòîðûé ïðåäîòâðàùàåò äåéñòâèå ïåðåêèñè âîäîðîäà. Ãðèáû êîíêóðèðóþò ñ êëåòêàìè ìàêðîîðãàíèçìà çà æåëåçî, íåîáõîäèìîå äëÿ ðàáîòû îêèñëèòåëüíûõ ïðîòèâîìèêðîáíûõ ñèñòåì ôàãîöèòîâ.
 ïîñëåäíèå ãîäû èçó÷àåòñÿ ïðîáëåìà ìîäóëÿöèè èììóííîãî îòâåòà, âûçâàííîé C. albicans. Áûëè âûñêàçàíû ïðåäïîëîæåíèÿ î âîçìîæíîé èíäóêöèè êëåòîê-ñóïðåññîðîâ ñ ïîìîùüþ àíòèãåíîâ C. albicans.  êà÷åñòâå êëåòîê-ñóïðåññîðîâ ïðåäëàãàëèñü CD8+ ëèìôîöèòû ñóïðåññîðû èëè CD4+Th2 êëåòêè, ïîäàâëÿþùèå àêòèâíîñòü ôàãîöèòîçà ñ ïîìîùüþ IL-4 è IL-10 (20, 26). Äîñòîâåðíûõ äîêàçàòåëüñòâ àêòèâíîé êàíäèäíîé èììóíîñóïðåññèè, ò. å. íàïðàâëåííîãî èçìåíåíèÿ èììóííîãî îòâåòà â ïîëüçó ãðèáà çà ñ÷åò åãî àíòèãåíîâ â íàñòîÿùåå âðåìÿ íåò. Íåäàâíèå èññëåäîâàíèÿ ïîêàçàëè, ÷òî â õîäå ðåãóëÿöèè èììóííîãî îòâåòà ìàêðîôàãè âûäåëÿþò IL-12 â òå÷åíèå îïðåäåëåííîãî îãðàíè÷åííîãî ïåðèîäà âðåìåíè.  ïîñëåäóþùåì àêòèâíîñòü IL-12 è îïîñðåäîâàííûõ èì IFN-çàâèñèìûõ ðåàêöèé ñíèæàåòñÿ, îñòàâëÿÿ ìåñòî IL-4 è IL-10, ïîäàâëÿþùèì êëåòî÷íûé èììóíèòåò(28). Ïîäîáíûé ìåõàíèçì ìîæåò îáåñïå÷èâàòü çàùèòíîå äåéñòâèå, îãðàíè÷èâàÿ ïî âðåìåíè (äîçèðóÿ) âûáðîñ ìàêðîôàãàìè òîêñè÷íûõ è äëÿ ãðèáà, è äëÿ ìàêðîîðãàíèçìà ïðîèçâîäíûõ êèñëîðîäà è àçîòà. Ñ äðóãîé ñòîðîíû, èììóíîìîäóëÿöèÿ ìîæåò îáåñïå÷èâàòü âûæèâàíèå ãðèáà ïðè íåçàâåðøåííîì ôàãîöèòîçå. Ïðîäîëæàþùàÿñÿ ïîñëå íåýôôåêòèâíîãî âûáðîñà ðàäèêàëîâ àíòèãåííàÿ ñòèìóëÿöèÿ âåäåò ê ïðåîáëàäàíèþ ðåàêöèé Th2 òèïà, ïîäàâëÿþùèõ äàëüíåéøóþ ôóíãèöèäíóþ àêòèâíîñòü. Âîçìîæíîñòü ó÷àñòèÿ ñïåöèôè÷åñêèõ àíòèãåíîâ C. albicans, íàïðèìåð ôðàãìåíòîâ ìàííàíà èëè áåëêîâ òåïëîâîãî øîêà â ìîäóëÿöèè èììóííîãî îòâåòà, à òàêæå àíòèãåííàÿ ìèìèêðèÿ C. albicans â íàñòîÿùåå âðåìÿ àêòèâíî èçó÷àþòñÿ.
Ëèòåðàòóðà
1. Ashman RB, Bolitho EM, Papadimitriou JM. Patterns of resistance to Candida albicans in inbred mouse strains. Immunol Cell Biol 1993 Jun 71 ( Pt 3): 221-5
2. Ashman RB, Papadimitriou JM. Production and function of cytokines in natural and acquired immunity to Candida albicans infection. Microbiol Rev 1995 Dec 59:4 646-72
3. Aubert D, Puygauthier-Toubas D, Leon P, Pignon B, Foudrinier F, Marnef F, Boulant J, Pinon JM. Characterization of specific anti-Candida IgM, IgA and IgE: diagnostic value in deep-seated infections. Mycoses 1996 May-Jun 39:5-6 169-76
4. Balish E, Vazquez-Torres FA, Jones-Carson J, Wagner RD, Warner T. Importance of beta2-microglobulin in murine resistance to mucosal and systemic candidiasis. Infect Immun 1996 Dec 64:12 5092-7
5. Beno DW, Mathews HL. Growth inhibition of Candida albicans by interleukin-2-induced lymph node cells. Cell Immunol 1990 Jun 128:1 89-100
6. Beno DW, Stever AG, Mathews HL. Growth inhibition of Candida albicans hyphae by CD8+ lymphocytes. J Immunol 1995 May 15 154:10 5273-81
7. Cassone A. Cell-mediated immunity mechanisms in fungal infections. In: Jacobs P, Nall L, eds. Fungal disease. Biology, immunology and diagnosis. Marcell Dekker, NY, 1997, pp. 130-1.
8. Cassone, A., S. Conti, F. De Bernardis, and L. Polonelli. Antibodies, killer toxins and antifungal immunoprotection: a lesson from nature. Immunol. Today 1997. 18:164-169.
9. Cenci E, Mencacci A, Spaccapelo R, Tonnetti L, Mosci P, Enssle KH, Puccetti P, Romani L, Bistoni F. T helper cell type 1 (Th1)- and Th2-like responses are present in mice with gastric candidiasis but protective immunity is associated with Th1 development. J Infect Dis 1995 May 1 71:5 1279-88
10. Cenci E, Romani L, Mencacci A, Spaccapelo R, Schiaffella E, Puccetti P, Bistoni F. Interleukin-4 and interleukin-10 inhibit nitric oxide-dependent macrophage killing of Candida albicans. Eur J Immunol 1993 May 23:5 1034-8
11. Chakir J, Cote L, Coulombe C, Deslauriers N. Differential pattern of infection and immune response during experimental oral candidiasis in BALB/c and DBA/2 (H-2d) mice. Oral Microbiol Immunol 1994 Apr 9:2 88-94
12. Colon MD, Toledo N, Valiente CL, Rodriguez N, Yano N, Mathews H, Yamamura Y. Antifungal and cytokine producing activities of CD8 + T lymphocytes from HIV-1 infected individuals. Bol Asoc Med P R 1998 Jan-Mar 90:1-3 21-6
13. Conti S, Berlottoni D, Fisicaro P, Polonelli L. Candida albicans stress mannoproteins as specific target of secretory IgA in mucosal candidiasis. Abstracts of the 13th ISHAM Congress. Parma, Italy, 1997.
14. De Bernardis F, Boccanera M, Adriani D, Spreghini E, Santoni G, Cassone A. Protective role of antimannan and anti-aspartyl proteinase antibodies in an experimental model of Candida albicans vaginitis in rats. Infect Immun 1997 Aug 65:8 3399-405
15. Eigentler A, Schulz TF, Larcher C, Breitwieser EM, Myones BL, Petzer AL, Dierich MP. C3bi-binding protein on Candida albicans: temperature-dependent expression and relationship to human complement receptor type 3. Infect Immun 1989 Feb 57:2 616-22
16. Fidel PL Jr, Wolf NA, KuKuruga MA. T lymphocytes in the murine vaginal mucosa are phenotypically distinct from those in the periphery. Infect Immun 1996 Sep 64:9 3793-9
17. Filler SG, Pfunder AS, Spellberg BJ, Spellberg JP, Edwards JE Jr. Candida albicans stimulates cytokine production and leukocyte adhesion molecule expression by endothelial cells. Infect Immun 1996 Jul 64:7 2609-17
18. Filler SG, Swerdloff JN, Hobbs C, Luckett PM. Penetration and damage of endothelial cells by Candida albicans. Infect Immun 1995 Mar 63:3 976-83
19. Fratti RA, Belanger PH, Ghannoum MA, Edwards JE Jr, Filler SG. Endothelial cell injury caused by Candida albicans is dependent on iron. Infect Immun 1998 Jan 66:1 191-6
20. Garner RE, Childress AM,. Human G, Domer E. Characterization of Candida albicans mannan-induced, mannan-specific delayed hypersensitivity suppressor cells. Infect. Immun. 1 990. 58:2613-2620
21. Gilmore, B. J., E. M. Retsinas, J. S. Lorenz, and M. K. Hostetter. An iC3b receptor on Candida albicans. J. Infect. Dis. 1988. 157:38-46. 188. Hazen, K. C., and P. M. Glee. 1994.
22. Gough PM, Warnock DW, Richardson MD, Mansell NJ, King JM. IgA and IgG antibodies to Candida albicans in the genital tract secretions of women with or without vaginal candidosis. Sabouraudia 1984 22:4 265-71
23. Gulay Z, Imir T. Anti-candidial activity of natural killer (NK) and lymphokine activated killer (LAK) lymphocytes in vitro. Immunobiology 1996 Jul 195:2 220-30
24. Han Y, Cutler JE. Antibody response that protects against disseminated candidiasis. Infect Immun 1995 Jul 63:7 2714-9
25. Heidenreich F, Dierich MP. Candida albicans and Candida stellatoidea, in contrast to other Candida species, bind iC3b and C3d but not C3b. Infect Immun 1985 Nov 50:2 598-600
26. Hisatsune T, Nishijima K, Minai Y, Kohyama M, Kaminogawa S. Autoreactive CD8+ T cell clones producing immune suppressive lymphokines IL-10 and interferon-. Cell. Immunol. 1994. 154:181-192
27. Jeganathan S, Ufomata D, Hobkirk JA, Ivanyi L. Immunoglobulin A1 and A2 subclass of salivary antibodies to Candida albicans in patients with oral candidosis. Clin Exp Immunol 1987 Nov 70:2 316-21
28. Jones P. 70 kDa heat shock protein of Candida albicans: high immunogenicity coupled with enhancement of infection. Abstracts of the 13th ISHAM Congress. Parma, Italy, 1997. P297, 152.
29. Jones-Carson J, Vazquez-Torres A, van der Heyde HC, Warner T, Wagner RD, Balish E. Gamma delta T cell-induced nitric oxide production enhances resistance to mucosal candidiasis. Nat Med 1995 Jun 1:6 552-7
30. Kauffmann SHE. Immunitu to intracellular microbial pathogens. Immunol Today 1995, 16: 338-342.
31. Kitz DJ, Stahl PD, Little JR. The effect of a mannose binding protein on macrophage interactions with Candida albicans. Cell Mol Biol 1992 Jul 38:4 407-12
32. Klingspor L, Eberhard TH, Stintzing G, Tollemar J. Antibody response to Candida and its use in clinical practice. Mycoses 1994 Jun-Jul 37:5-6 199-204
33. Knoke M, Bernhardt H, Shultz K. Differentiation of immunoglobulin subclasses by a Candida -ELISA. Abstracts of the 13th ISHAM Congress. Parma, Italy, 1997. P293, 151.
34. Kozel TR. Activation of the complement system by pathogenic fungi. Clin Microbiol Rev 1996 Jan 9:1 34-46
35. Kretschmar M, Jung C, Fontagnier E, Quade B, Nichterlein T, Hof H. Activated CD8+ T cells are involved in elimination of Candida albicans from the livers of mice. Mycoses 1997 Jan-Feb 40:1-2 41-6
36. L Romani, A Mencacci, E Cenci, R Spaccapelo, E Schiaffella, L Tonnetti, P Puccetti and F Bistoni. Natural killer cells do not play a dominant role in CD4+ subset differentiation in Candida albicans-infected mice. Infect. Immun.1993, Vol 61, Sept 9: 3769-3774
37. Li SP, Lee SI, Wang Y, Domer JE. Candida albicans mannan-specific, delayed hypersensitivity down-regulatory CD8+ cells are genetically restricted effectors and their production requires CD4 and I-A expression. Int Arch Allergy Immunol 1996 Apr 109:4 334-43
38. Ludviksson, B. R., O. Thorarensen, T. Gudnason, and S. Halldorsson. Candida albicans meningitis in a child with myeloperoxidase deficiency. Pediatr. Infect. Dis. 1993. J. 12:162-164
39. Marodi L, Johnston RB Jr. Enhancement of macrophage candidacidal activity by interferon-gamma. Immunodeficiency 1993 4:1-4 181-5
40. Marodi L, Korchak HM, Johnston RB Jr. Mechanisms of host defense against Candida species. I. Phagocytosis by monocytes and monocyte-derived macrophages. J Immunol 1991 Apr 15 146:8 2783-9
41. Marodi L, Schreiber S, Anderson DC, MacDermott RP, Korchak HM, Johnston RB Jr. Enhancement of macrophage candidacidal activity by interferon-gamma. Increased phagocytosis, killing, and calcium signal mediated by a decreased number of mannose receptors. J Clin Invest 1993 Jun 91:6 2596-601
42. Marodi L, Tournay C, Kaposzta R, Johnston RB Jr, Moguilevsky N. Augmentation of human macrophage candidacidal capacity by recombinant human myeloperoxidase and granulocyte-macrophage colony-stimulating factor. Infect Immun 1998 Jun;66(6):2750-4
43. Martinez JP, Gil ML, Lopez-Ribot JL, Chaffin WL. Serologic response to cell wall mannoproteins and proteins of Candida albicans. Clin Microbiol Rev 1998 Jan 11:1 121-41
44. Mencacci A, Spaccapelo R, Del Sero G, Enssle KH, Cassone A, Bistoni F, Romani L. CD4+ T-helper-cell responses in mice with low-level Candida albicans infection. Infect Immun 1996 Dec 64:12 4907-14
45. Mencacci A, Torosantucci A, Spaccapelo R, Romani L, Bistoni F, Cassone A. A mannoprotein constituent of Candida albicans that elicits different levels of delayed-type hypersensitivity, cytokine production, and anticandidal protection in mice. Infect Immun 1994 Dec 62:12 5353-60
46. Nancy Vazquez, Thomas J. Walsh, Daphne Friedman, Stephen J. Chanock, and Caron A. Lyman. Interleukin-15 Augments Superoxide Production and Microbicidal Activity of Human Monocytes against Candida albicans. Infect. Immun. 1998 66: 145-150.
47. Nikawa H, Samaranayake LP, Tenovuo J, Pang KM, Hamada T. The fungicidal effect of human lactoferrin on Candida albicans and Candida krusei. Arch Oral Biol 1993 Dec 38:12 1 057-63
48. Okuda, T., T. Yasuoka, and N. Oka. Myeloperoxidase deficiency as a predisposing factor for deep mucocutaneous candidiasis: a case report. J. Oral Maxillofac. Surg. 1991. 49:183-186
49. Palma C, Cassone A, Serbousek D, Pearson CA, Djeu JY. Lactoferrin release and interleukin-1, interleukin-6, and tumor necrosis factor production by human polymorphonuclear cells stimulated by various lipopolysaccharides: relationship to growth inhibition of Candida albicans. Infect Immun 1992 Nov 60:11 4604-11
50. R, Ponzi AN, Badolato R Musso T, Calosso L, Zucca M, Millesimo M, Puliti M, Bulfone-Paus S, Merlino C, Savoia D, Cavallo. Interleukin-15 activates proinflammatory and antimicrobial functions in polymorphonuclear cells. Infect Immun 1998 Jun 66:6 2640-7
51. RA Fratti, MA Ghannoum, JE Edwards Jr and SG Filler. Gamma interferon protects endothelial cells from damage by Candida albicans by inhibiting endothelial cell phagocytosis. Infect. Immun., 11 1996, 4714-4718, Vol 64, No. 11
52. Reinholdt J, Krogh P, Holmstrup P. Degradation of IgA1, IgA2, and S-IgA by Candida and Torulopsis species. Acta Pathol Microbiol Immunol Scand 1987 Dec 95:6 265-74
53. Richardson MD, Brownlie CE, Shankland GS. Enhanced phagocytosis and intracellular killing of Candida albicans by GM-CSF-activated human neutrophils. J Med Vet Mycol 1992 30:6 433-41
54. Rittig MG, Schruppel K, Seack KH, Sander U, N’Diaye EN, Maridonneau-Parini I, Solbach W, Bogdan C. Coiling phagocytosis of trypanosomatids and fungal cells. Infect Immun 1998 Sep 66:9 4331-9
55. Romani L, Mocci S, Bietta C, Lanfaloni L, Puccetti P, Bistoni F. Th1 and Th2 cytokine secretion patterns in murine candidiasis: association of Th1 responses with acquired resistance. Infect Immun 1991 Dec 59:12 4647-54
56. Romani L, Puccetti P, Mencacci A, Cenci E, Spaccapelo R, Tonnetti L, Grohmann U, Bistoni F. Neutralization of IL-10 up-regulates nitric oxide production and protects susceptible mice from challenge with Candida albicans. J Immunol 1994 Apr 1 152:7 3514-21
57. Rosati E, Scaringi L, Cornacchione P, Fettucciari K, Sabatini R, Rossi R, Marconi P. Cytokine response to inactivated Candida albicans in mice. Cell Immunol 1995 May 162:2 256-64
58. Samaranayake YH, Samaranayake LP, Wu PC, So M. The antifungal effect of lactoferrin and lysozyme on Candida krusei and Candida albicans. APMIS 1997 Nov 105:11 875-83
59. Scaringi L, Rosati E, Cornacchione P, Fettucciari K, Sabatini R, Biondi R, Mezzasoma L, Valiani M, D’Errico P, Marconi P. Local and systemic immune response to inactivated Candida albicans in mice.//Nat Immun 1995 Sep 14:5-6 234-49
60. Shen HD, Choo KB, Tang RB, Lee CF, Yeh JY, Han SH. Allergenic components of Candida albicans identified by immunoblot analysis.// Clin Exp Allergy 1989 Mar 19:2 191-5
61. Shepherd VL, Lane KB, Abdolrasulnia R. Ingestion of Candida albicans down-regulates mannose receptor expression on rat macrophages.// Arch Biochem Biophys 1997 Aug 15 344:2 350-6
62. Smith PD, Lamerson CL, Banks SM, Saini SS, Wahl LM, Calderone RA, Wahl SM. Granulocyte-macrophage colony-stimulating factor augments human monocyte fungicidal activity for Candida albicans. J Infect Dis 1990 May;161(5):999-1005
63. Stein, M., Keshav S., Harris N., Gordon S. Interleukin 4 potently enhances murine macrophage mannose receptor activity: a marker of alternative immunologic macrophage activation. J. Exp. Med. 1992.176:287-292
64. Stuehr D, Marletta M: Induction of nitrite/nitrate synthesis in murine macrophages by BCG infection, lymphokines, or interferon-gamma. J Immunol 1987 139:518-525
65. Szabo I, Guan L, Rogers TJ. Modulation of macrophage phagocytic activity by cell wall components of Candida albicans. Cell Immunol 1995 Sep 164:2 182-8
66. Thong YH, Ferrante A. Alternative pathway of complement activation by Candida albicans. Aust N Z J Med 1978 Dec 8:6 620-2
67. Tonnetti L, Spaccapelo R, Cenci E, Mencacci A, Puccetti P, Coffman RL, Bistoni F, Romani L. Interleukin-4 and -10 exacerbate candidiasis in mice. Eur J Immunol 1995 Jun 25:6 1559-65
68. Vazquez-Torres FA, Balish E. Macrophages in resistance to candidiasis. Microbiol. Mol. Biol. Rev. 1997, 61, 2:170-192.
69. Vudhichamnong K, Walker DM, Ryley HC. The effect of secretory immunoglobulin A on the in-vitro adherence of the yeast Candida albicans to human oral epithelial cells. Arch Oral Biol 1 982 27:8 617-21
70. Wang Y, Li S, Moser A, Bost K,. Domer J. Cytokine Involvement in Immunomodulatory Activity Affected by Candida albicans Mannan Infect. Immun. 1998 66: 1384-1391.
72. Werle E, Kappe R, Fiehn W, Sonntag HG. Detection of anti-Candida antibodies of the classes IgM, IgG and IgA using enzyme immunoassay in sequential serum samples of hospitalized patients. Mycoses 1994 37 Suppl 1: 71-8
73. Wojdani A, Ghoneum M. In vivo augmentation of natural killer cell activity by Candida albicans. Int J Immunopharmacol 1987 9:7 827-32
74. Zhang MX, Lupan DM, Kozel TR. Mannan-specific immunoglobulin G antibodies in normal human serum mediate classical pathway initiation of C3 binding to Candida albicans. Infect Immun 1997 Sep 65:9 3822-7
Íàïèñàòü êîììåíòàðèé
Источник