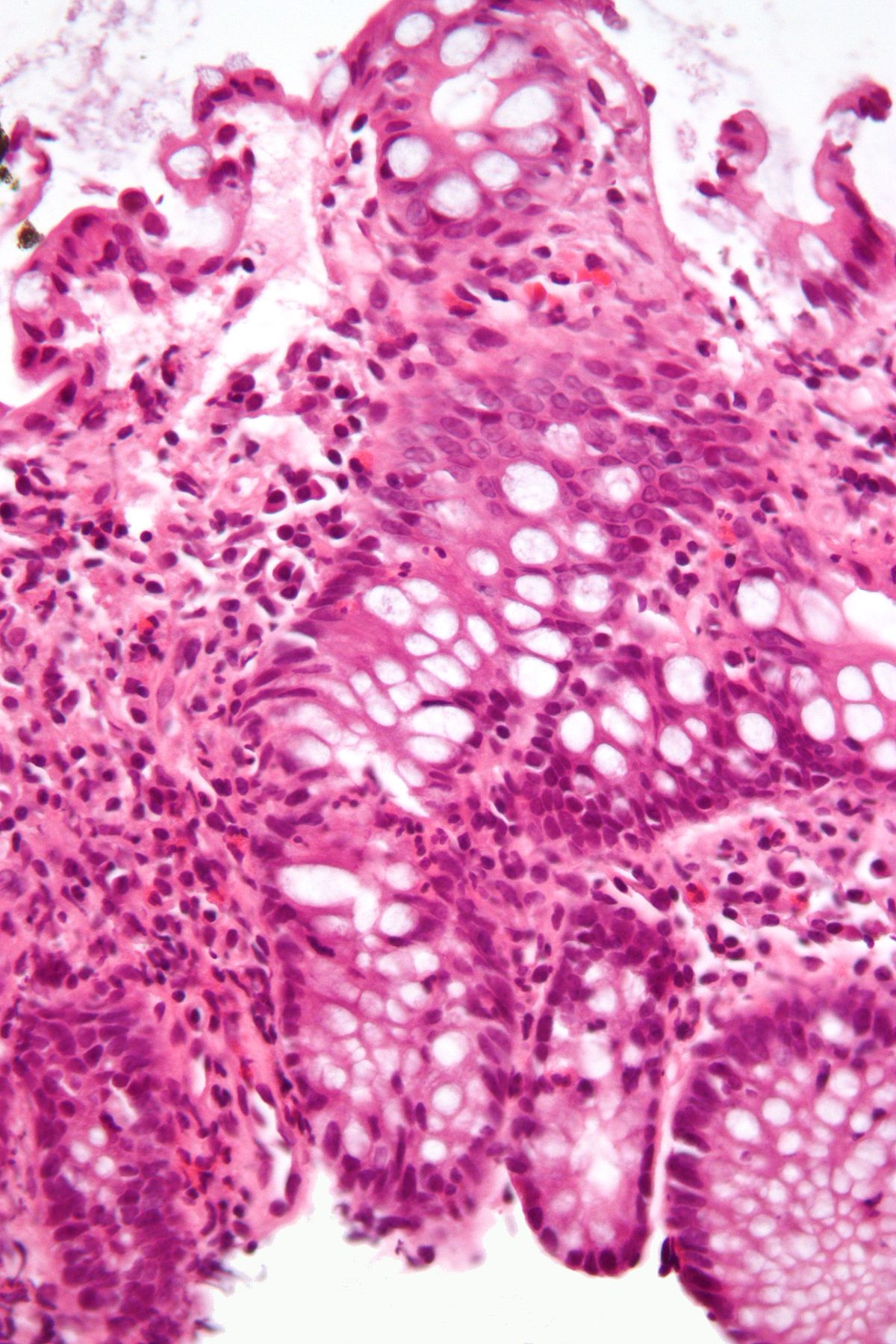
Псевдомембранозный колит этиология патогенез клиника
Доказано, что Clostridium difficile может обнаруживаться в стуле здоровых людей. Одновременноо, имеются убедительные данные, указывающие на то, что эти микроорганизмы не способны к длительному существованию в неизмененной нормальной микроэкосистеме кишечника.
Для осуществления патогенных свойств этого микроорганизма необходимы условия, способствующие его избыточному росту, которые возникают в результате применения антибиотиков, то есть проведения антибиотикотерапии.
К основным антибактериальным препаратам, связанным с развитием псевдомембранозного колита, относят цефалоспорины (особенно 2 и 3 поколений), ампициллин, амоксциллин и клиндамицин. Менее причинно-значимыми антибиотиками являются макролиды (эритромицин, кларитромицин, азитромицин) и другие пенициллины. Однако следует учитывать, что практически любой антибактериальный препарат может привести к возникновению псевдомембранозного колита.
Длительное применение антибиотиков или же одновременное применение 2-х и более антибактериальных препаратов ещё более повышает риск развития псевдомембраного колита.
Заболевание развивается при развитии резистентности Clostridium difficile к антибиотикам, подавляющим жизнедеятельность прочей кишечной микрофлоры. Таким образом, возникновение псевдомембранозного колита является результатом развития своеобразного «клостридиального» дисбактериоза у больных под влиянием различных предрасполагающих факторов.
Патогенные штаммы C. difficile продуцируют токсин А и токсин В. Токсин А — мощный энтеротоксин с цитотоксической активностью, вызывающий нарушение барьерной функции слизистой кишечника за счет повреждения эпителиоцитов и активацию секреции жидкости в просвет кишечника. Токсин B – цитотоксин, в 1000 раз более мощный цитотоксин, чем токсин А, его цитотоксический эффект обусловлен нарушением полимеризации внутриклеточных филаментов актина).
Токсины C.difficile воздействует на слизистую оболочку кишечника, вызывая в ней глубокие изменения, вплоть до перфорации. Некоторые антибиотики, особенно линкомицин, клиндамицин, ампициллин индуцируют продукцию цитотоксина, повышая его уровень в 16-128 раз без прироста биомассы микроорганизма; несколько меньше, но также повышается продукция энтеротоксина.
У C.difficile описаны плазмиды, которые участвуют в переносе устойчивости к антибиотикам.
Выявляемые в толстой кишке морфологические изменения слизистой обусловлены действием только токсинов, поскольку сами клостридии не обладают инвазивными свойствами и, как правило, в подслизистый слой не проникают. Протяженность и глубина морфологических изменений, выявляемых в толстой кишке, обусловливают тяжесть течения инфекционного процесса.
- Предрасполагающие факторы развития псевдомембраного колита
Помимо антибиотикотерапии (основного предрасполагающего фактора) кдругим предрасполагающим факторам развития псевдомембраного колита относят:
- Возраст старше 60 лет.
- Нахождение в стационаре (особенно в одной палате с инфекционным больным или в реанимационном отделении).
- Операции на органах брюшной полости.
- Применения цитостатических препаратов (особенно метотрексата).
- Гемолитико-уремический синдром.
- Злокачественные заболевания.
- Ишемия кишечника.
- Почечная недостаточность.
- Некротический энтероколит.
- Болезнь Гиршпрунга.
- Хронические воспалительные заболевания кишечника.
- Различные желудочно-кишечные нехирургические манипуляции (например, установка назогастрального зонда).
Источник
Введение
Врачи достаточно часто сталкиваются с диареей развивающейся у пациентов, на фоне или после применения антибиотиков. В России как больные, так и ряд врачей склонны связывать ее появление с «дисбактериозом». Зарубежные специалисты в этом случае говорят об «антибиотик-ассоциированной диарее». Clostridium difficile является возбудителем наиболее тяжелых форм данного осложнения, вплоть до развития фульминантного колита и токсической дилатации толстой кишки. По данным канадских исследователей уровень заболеваемости связанной с инфекцией данным возбудителем составляет от 30,8 до 40,3 случая на 100 тыс. больных (в больницах с более 200 коек) [1]. У 10 % пациентов получающих антибиотики развивается диарея, но только в 1 % случаев возникает псевдомембранозный колит.
Этиология и патогенез
Clostridium difficile это спорообразующий, анаэробный микроорганизм впервые описанный в 1935 году [7]. Однако роль токсинов Clostridium difficile в развитии псевдомембранозного колита была установлена только к 1978 году [6]. Микроорганизм далеко не всегда вызывает развитие заболевания (т.к. существуют штаммы, не продуцирующие токсины), а его тяжесть может варьировать от легкой диареи, без признаков колита, до угрожающих жизни состояний.
Патогенез заболевания включает следующие этапы
- нарушение нормальной микрофлоры толстой кишки (в норме стул содержит более 500 различных бактерий в концентрации 10 в 12 степени в одном грамме);
- колонизация толстой кишки продуцирующими токсин штаммами Clostridium difficile;
- выработка токсинов (А и В);
- воспаление и повреждение слизистой оболочки толстой кишки (до некроза эпителия и образования мембран в тяжелых случаях).
Чаще всего к развитию заболевания приводит применение клиндамицина, линкамицина, цефалоспоринов и защищенных пенициллинов [3]. Кроме недавнего (обычно не позднее 2 месяцев) применения антибиотиков риск развития инфекции повышен у лиц старше 60 лет, стационарных больных, пациентов с ослабленным иммунитетом, почечной недостаточностью, онкологическими заболеваниями и у лиц получающих антисекреторную терапию.
Клиника
К типичным симптомам данной патологии относятся диарея (стул водянистый, небольшого объема, от 4 до 20 раз в сутки, без примесей крови), схваткообразная боль в животе, а также слабость, анорексия и тошнота. Не специфическими, хотя и весьма характерными для инфекции Clostridium difficile признаками являются лейкоцитоз (до 15х109/л, а иногда и выше), гипоальбуминемия и лейкоциты в кале.
При заболевании легкой степени развивается водянистая диарея, не сопровождающаяся системными симптомами и явлениями колита при эндоскопическом обследовании.
При средней степени тяжести кроме диареи беспокоят сваткообразные боли в животе, вздутие живота, наблюдается умеренная дегидратация, тахикардия до 100 ударов в минуту, умеренный лейкоцитоз с нейтрофильным сдвигом, умеренное снижение артериального давления. При эндоскопии можно часто наблюдать характерную для псевдомембранозного колита картину.
При тяжелом течении на первое место выходят системные проявления – спутанное сознание, лихорадка, тахикардия больше 100 ударов в минуту, падение давления ниже 100 мм рт. ст., вентиляционные нарушения, высокий лейкоцитоз (до лейкемойдной реакции), развиваться токсическая делатация толстой кишки, ее перфорация, перитонит. У пациентов с таким вариантом заболевания диарея можем отсутствовать, в результате токсической дилатации толстой кишки [10].
При рентгенологическом исследовании или компьютерной томографии визуализируются «отпечатки большого пальца» свидетельствующие об отеке слизистой толстой кишки и/или дилатация толстой кишки. По данным Dallal et. al., [4] из 39 пациентов с колитом, он носил правосторонний характер у 11, левосторонний у 9 и тотальный у 19. Эндоскопическая картина может варьировать от нормы до диффузного или очагового колита с или без образования псевдомембран. Исследование не должно выполняться при подозрении на токсическую дилатацию в связи с риском перфорации толстой кишки.
Стандартом диагностики является определение токсинов Clostridium difficile в кале. Желательно проводить определение как токсина А, так и В т.к 1-2 % штаммов Clostridium difficile продуцируют только токсин В [9]. Методика, основанная на действии цитотоксина в культуре ткани обладает высокой чувствительностью (94-100 %) и специфичностью (99 %) [10,11]. Несмотря на то, что она позволяет выявить токсин в количестве 10 pg и рассматривается в качестве «золотого стандарта» диагностики, ее проводят в немногих лабораториях, а время до получения результата занимает 24-48 часов [3].
Существует иммуноферментный метод определения токсина А и/или В в стуле. Результат исследования становиться известным в течение нескольких часов, но его чувствительность (65-85 %) и специфичность (95-100 %) ниже [2, 16]. Данный тест требует присутствия большего количества токсина для получения положительного результата (100-1000 pg) [3]. Несмотря на это, данную методику рассматривают как диагностический тест выбора у лиц с частотой стула более 6 раз в день [8]. У 5-20 % больных необходимо не однократное исследование стула для выявления токсина [14].
Получение культуры Clostridium difficile в анаэробных условиях для диагностики используется редко, во первых потому, что это занимает несколько дней, а во вторых не позволяет различить патогенные и не патогенные штаммы. Получение культуры с оценкой ее токсигенности позволяет избежать этой проблемы, но методика весьма трудоемка и занимает несколько суток.
Другие диагностические тесты включают реакцию латексной аглютенации (на клостридиальный белок глутамат дегидрогеназу, но она имеет относительно низкую чувствительность и специфичность) и определение токсинов путем полимеразной цепной реакции (находиться в процессе стандартизации).
Лечение
Одним из важнейших этапов лечения является отмена антибиотика вызвавшего заболевание (если это возможно). При легкой степени инфекции этого бывает достаточно для выздоровления [5]. При необходимости продолжения антибиотикотерапии лучше использовать препараты реже вызывающие развитие клостридиальной инфекции: аминогликозиды, сульфаниламиды, макролиды, тетрациклин и фторхинолоны.
В случае более тяжелого течения данной патологии необходимо назначение препаратов направленных на подавления Clostridium difficile. В качестве лечения выбора рассматривается Метронидазол 250 мг 4 раза в сутки или 500 мг 3 раза [15]. Ванкомицин (125 мг 4 раза в сутки) применяется при непереносимости метронидазола или его неэффективности [13]. Эффективность обеих препаратов сходна [17,18]. В обоих случаях длительность терапии 10-14 дней (улучшение состояние должно наступить в течение 72 часов). Если пациент продолжает лечение другими антибиотиками то метронидазол (ванкомицин) должен применяться весь период лечения и неделю после его прекращения [13]. Ванкомицин практически не всасывается и, следовательно, дает меньше побочных эффектов, но значительно дороже метронидазола.
Антиперистальтические агенты категорически противопоказаны. В качестве адсорбента рекомендуется холестирамин [12], но т.к. в России он отсутствует, мы с успехом вместо него используем смекту (в стандартных дозах). У пациентов с тяжелым колитом, которые не могут принимать препараты перорально, применяется метронидазол внутривенно, он выделяется в желчь и достигает достаточно высокой концентрации в просвете ЖКТ, но не ванкомицин т.к. при парентеральном введении последний в просвет ЖКТ практически не экскретируется. Впрочем, можно вводить ванкомицин (парентеральная форма) через назогастральный зонд или непосредственно в толстую кишку [13]. Не следует забывать о полноценной регидратации (пероральной или инфузионной) и коррекции электролитных нарушений.
В 10-20 % случаев при прекращении лечения возникает рецидив заболевания [19]. Он проявляется повторным возникновением симптомов через 3-21 день после прекращения применения метронидазола или ванкомицина. В таких случаях показана повторная терапия метронидазолом или ванкомицином, разумным является добавления лактобактерий и пробиотиков (хотя их эффективность не доказана).
У 0.4 %- 3,6 % пациентов требуется хирургическое лечение [13]. Наиболее частыми показаниями к операции является перитонит и токсическая дилатация толстой кишки с высоким риском перфорации. Операцией выбора является субтотальная колэктомия, но уровень летальности при ее выполнении достигает 57 % [4].
В заключение приведем схему лечения применяемую нами:
- Отмена антибиотиков (если возможно) или замена их на относительно безопасные (аминогликозиды, макролиды, фторхинолоны).
- Отмена всех антиперистальтических агентов и опиойдных анальгетиков.
- Смекта (стандартная дозировка).
- Линекс или хилак-форте (стандартная дозировка).
- Метронидазол 250 мг 4 раза в день (при системных проявлениях, частоте стула более 4 в сутки или необходимости продолжать антибиотикотерапию).
- Ванкомицин 125 мг 4 раза в сутки (при непереносимости, неэффективности метронидазола или при тяжелой инфекции).
- Метронидазол внутривенно (ванкомицин через назогастральный зонд) при невозможности самостоятельного приема препаратов.
- Коррекция водно-электролитных нарушений.
Литература
- Alfa M. J., Dul T., Beda G. Sulrvey of incidence of Clostridiulm difficile infection in Canadian hospitals and diagnostic approaches// J. Clin. Microbiol. 1998. V. 36. P. 2076-2080.
- Barbut F., Kajzer C., Planas N., Petit J.C. Comparison of three enzyme immunoassays, a cytotoxicity assay, and toxigenic culture for diagnosis of Clostridium difficile-associated diarrhea. J Clin Microbiol 1993;31:963-7.
- Bartlett J. G. ANTIBIOTIC-ASSOCIATED DIARRHEA N Engl J Med, Vol. 346, No 56: 334-339.
- Dallal M.R. Fulminant Clostridium difficile: An Underappreciated and Increasing Cause of Death and Complications. Ann Surg. 2002 March; 235(3): 363–372.
- Fekety R. Guidelines for the diagnosis and management of Clostridium
difficile-associated diarrhea and colitis. Am J Gastroenterol 1997;92:739-50. - George R.H., Symonds J.M., Dimock F., et al. Identification of Clostridium difficile as a cause of pseudomembranous colitis. BMJ 1978;1:695.
- Hall I.C., O’Toole E. Intestinal flora in newborn infants with a description of a new pathogenic anaerobe, Bacillus difficilis. Am J Dis Child 1935; 49:390-402.
- Jacobs J., Rudensky B., Dresner J., et al. Comparison of four laboratory tests for diagnosis of Clostridium difficile–associated diarrhea. Eur J Clin Microbiol Infect Dis 1996;15: 561-6.
- Johnson S., Kent S.A., O’Leary K.J., et al. Fatal pseudomembranous colitis associated with a variant Clostridium difficile strain not detected by toxin A immunoassay. Ann Intern Med 2001;135:434-8
- Kelly C.P., Pothoulakis C., LaMont J.T. Clostridium difficile colitis. N Engl J Med 1994;330:257-62
- Kelly CP, LaMont JT. Clostridium difficile infection. Annu Rev /Med 1998;49:375-90.
- Kreutzer E.W., Milligan F.D. Treatment of antibiotic-associated pseudomembranous colitis with cholestyramine resin. Johns Hopkins Med J 1978;143:67-72.
- Malnick S., Zimhony O. Treatment of Clostridium difficile–Associated Diarrhea. Ann Pharmacother 2002;36:1767-75.
- Manabe Y.C., Vinetz J.M., Moore R.D., Merz C., Carache P., Bartlett J.G. Clostridium difficile colitis: an efficient clinical approach to diagnosis. Ann Intern Med 1995;123:835- 40.
- Mylonakis E., Ryan E.T., Calderwood S.B. Clostridium difficile–associated diarrhea. A review. Arch Intern Med 2001;161:525-33.
- Staneck J.L., Weckbach L.S., Allen S.D., et al. Multicenter evaluation of four methods for Clostridium difficile detection: immunoCard C. difficile, cytotoxin assay, culture, and latex agglutination. J Clin Microbiol 1996;34:2718-21.
- Teasley D.G., Gerding D.N., Olson M.M., et al. Prospective randomised trial of metronidazole versus vancomycin for Clostridium-difficile-associated diarrhoea and colitis. Lancet 1983;2:1043-1046.
- Wenisch C., Parschalk B., Hasenhundl M., Hirschl A.M., Graninger W. Comparison of vancomycin, teicoplanin, metronidazole, and fusidic acid for the treatment of Clostridium difficile-associated diarrhea. Clin Infect Dis 1996;22:813-8.
- Young G., McDonald M. Antibiotic-associated colitis: why do patients relapse? Gastroenterology 1986;90:1098-1099.
Источник