Судьба лактата в организме цикл кори
Метаболическая регуляция мышечного сокращения
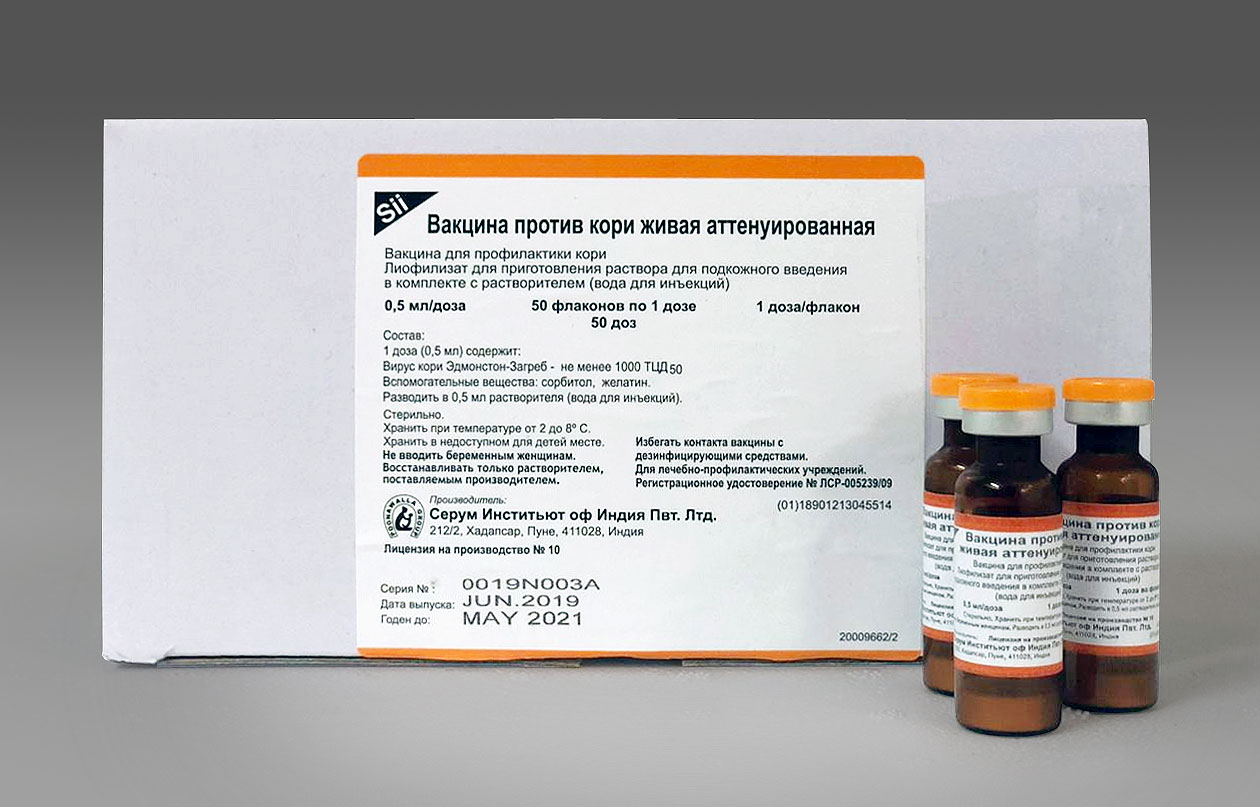
А. Циклы Кори и
аланина
В клетках, не содержащих митохондрий
(например, в эритроцитах), или в тканях при недостаточном снабжении кислородом
(например, в активно работающих мышцах) АТФ (АТР) синтезируется за счет процесса
превращений глюкозы в лактат, т. е. за счет процесса брожения (= анаэробного
гликолиза, см. рис. 153). Лактат переносится кровью в печень, где в
процессе глюконеогенеза с затратой АТФ (см. рис. 157) вновь конвертируется
в глюкозу (цикл Кори).
При интенсивной работе мышцы максимально
активируется гликолиз. Продукт гликолиза, пировиноградная кислота (пируват)
накапливается в цитоплазме и недостаточно быстро поступает в митохондрии, если
они из-за недостатка кислорода не готовы к окислению пирувата. В анаэробных
условиях пируват в реакции, катализируемой лактатдегидрогеназой (см. рис.
103) (заключительный этап гликолиза) восстанавливается до лактата.
Одновременно
НАДН (NADH), кофермент лактатдегидрогеназы, окисляется до НАД+
(NAD+), который вновь используется на окислительном этапе
гликолитического пути. Этой реакции способствует относительно высокое отношение
НАДН/НАД+ в мышечной ткани. Лактат диффундирует в кровь и поступает в
печень, где конвертируется в глюкозу. Таким образом, образование лактата
временно заменяет аэробный метаболизм глюкозы и частично переносит этот процесс
из мышц в печень.
Обратная связь, подобная циклу Кори,
существует в цикле аланина, в котором также участвует пируват.
Цикл аланина берет начало с протеолиза белков. Образующиеся аминокислоты
в результате трансаминирования в присутствии ферментов превращаются в
α-кетокислоты (на схеме не приведено, см. рис. 181), которые в основном включаются
в цикл трикарбоновых кислот (цитратный цикл) (см. рис. 183).Одновременно в
реакции, катализируемой аланинтрансаминазой, аминогруппы из разных аминокислот
переносятся на имеющийся субстрат, пируват. Образующийся аланин поступает
в кровь и переносится в печень. Таким образом, цикл аланина служит каналом
передачи азота и предшественников глюкозы в печень, которая является местом
синтеза конечных продуктов азотистого обмена, например мочевины (см. рис.
185).
Следует напомнить, что при анаэробном
гликолизе образуются кислоты, которые, не принимая участие в последующем обмене,
существуют в форме анионов. Поэтому при интенсивном анаэробном гликолизе рН
мышечной клетки может понизиться настолько, что сокращение станет невозможным.
Обычно этого не происходит благодаря быстрому выходу кислых метаболитов (лактата
и пирувата) в кровь, которая также может оказаться закисленной
(метаболический ацидоз).
Б. Метаболизм белков и
аминокислот
Скелетные мышцы активно участвуют в
метаболизме аминокислот. Это наиболее важный участок деградации разветвленных
аминокислот (Val и Ile, см. с. 402). Ряд других аминокислот также
деградируются преимущественно в мышцах. Одновременно идет ресинтез и
высвобождение в кровь аланина и глутамина. Эти аминокислоты служат
переносчиками азота, образующегося при расщеплении белков, в печень (цикл
аланина) и почки (см. рис. 319).
При голодании мышечные белки
служат энергетическим резервом организма. Они гидролизуются до аминокислот,
которые поступают в печень. Здесь углеродный скелет аминокислот конвертируется в
промежуточные продукты цитратного цикла, в том числе в ацетоацетил-КоА и
ацетил-КоА (см. рис. 183). Эти амфиболические соединения окисляются в цикле
трикарбоновых кислот или включаются в процесс
глюконеогенеза.
Синтез и расщепление мышечных белков
контролируются гормонами. Тестостерон и синтетические анаболики
стимулируют биосинтез белка; напротив, кортизол подавляет образование
мышечных белков.
Белки актин и миозин содержат остатки
гистидина, метилированного на стадии посттрансляционной модификации. При
расщеплении этих белков образуется 3-метилгистидин, который дальше не
разрушается. Количество метилгистидина в моче служит мерой деградации мышечных
белков.

Источник
Глюкоза
+ 2 АДФ + 2 H3PO4 =
2 Лактат + 2 АТФ + 2 Н2О
В
анаэробном гликолизе АТФ образуется
только за счет субстратного фосфорилирования
(2
моль АТФ на 1моль глюкозы).
Значение
анаэробного гликолиза особенно велико
для скелетных мышц. В интенсивно
работающих скелетных мышцах мощность
механизма транспорта кислорода
оказывается недостаточной для обеспечения
энергетической потребности, в этих
условиях резко усиливается анаэробный
гликолиз, и в мышцах накапливается
молочная кислота. Особое значение
анаэробный гликолиз имеет при
кратковременной интенсивной работе.
Так, бег в течение 30 с полностью
обеспечивается анаэробным гликолизом.
Однако уже через 4-5 мин бега энергия
поставляется поровну анаэробным и
аэробным процессами, а через 30 мин —
почти целиком аэробным процессом. При
длительной работе в аэробном процессе
используется не глюкоза, а жирные
кислоты.
Эритроциты
вообще не имеют митохондрий, поэтому
их потребность в АТФ удовлетворяется
только за счет анаэробного гликолиза.
Интенсивный гликолиз характерен также
для злокачественных опухолей.
Цикл Кори (глюкозо-лактатный цикл) и глюкозо-аланиновый цикл.
Молочная
кислота не является конечным продуктом
обмена, но ее образование — тупиковый
путь метаболизма: ее дальнейшее
использование связано опять с превращением
в пируват. Из клеток, в которых происходит
гликолиз, образующаяся молочная кислота
поступает в кровь и улавливается в
основном печенью, где и превращается в
пируват. Пируват в печени частично
окисляется, а частично превращается в
глюкозу. Часть пирувата в мышцах путем
трансаминирования превращается в
аланин, который транспортируется в
печень, и здесь снова образует пируват.
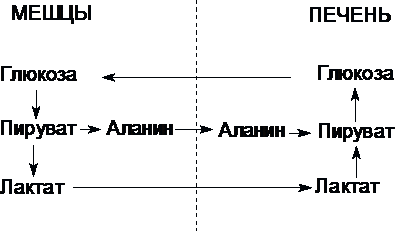
Рис.
Цикл Кори и глюкозо-аланиновый цикл
Биосинтез глюкозы (глюконеогенез).
Глюконеогенез
протекает в основном по тому же пути,
что и гликолиз, но в обратном направлении.
Однако три реакции гликолиза необратимы,
и на этих стадиях реакции глюконеогенеза
отличаются от реакций гликолиза.
Обходные пути глюконеогенеза.
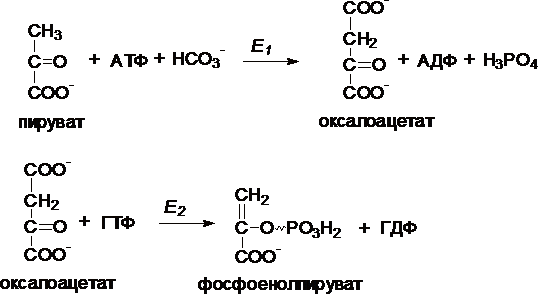
I.
Первый обходной путь — превращение
пирувата в фосфоенолпируват.
Это
превращение осуществляется под действием
двух ферментов — пируваткарбоксилазы
(Е1) и карбокикиназы
фосфоенолпирувата (Е2).
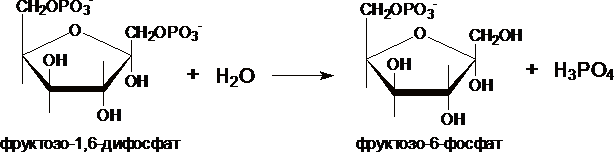
II. Превращение
фруктозо-1,6-дифосфата во
фруктозо-6-фосфат катализирует
фермент фруктозо-1,6-дифосфатаза.
III. Образование
глюкозы из глюкозо-6-фосфата катализирует
фермент глюкозо-6-фосфотаза .
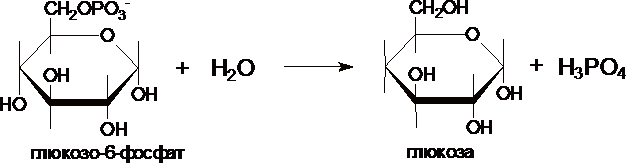
Этот
фермент отсутствует в клетках мозга,
скелетных мышц и др. тканях, поэтому
глюконеогенез, протекающий в этих тканях
не может поставлять глюкозу в кровь.
Глюкозо-6-фосфатаза локализована в
почках и, особенно, в печени, и
глюкозо-6-фосфат может превращаться в
глюкозу, если ее уровень в крови снижен.
Пентозофосфатный путь (пфп). Значение пфп.
Большая
часть глюкозы расщепляется по
гликолитическому пути. Наряду с гликолизом
существуют второстепенные пути
катаболизма глюкозы, одним из которых
является пентозофосфатный путь (ПФП).
Пентозофосфатный путь скорее даже —
анаболический путь, который использует
6 атомов С глюкозы для синтеза пентоз и
восстановительных эквивалентов в виде
НАДФН, необходимых для образования
липидов в организме. Однако, этот путь
— окисление глюкозы, и при определенных
условиях может завершиться полным
окислением глюкозы до СО2 и
Н2О.
Главные функции этого цикла следующие:
Генерирование
восстановительных эквивалентов в виде
НАДФН для восстановительных реакций
биосинтеза. Ферменты, которые катализируют
реакции восстановления, часто используют
в качестве кофактора НАДФ+/НАДФН,
а окислительные ферменты — НАД+/НАДН.
Восстановительные реакции биосинтеза
жирных кислот и стероидных гормонов
требуют НАДФН, поэтому клетки печени,
жировой ткани и др., где протекает синтез
липидов, имеют высокий уровень ферментов
ПФП. В печени около 30% глюкозы подвергаются
превращениям в
ПФП.
НАДФН
используется при обезвреживании лекарств
и чужеродных веществ в монооксигеназной
цепи окисления в печени.
НАДФН
предохраняет ненасыщенные жирные
кислоты эритроцитарной мембраны от
аномальных взаимодействий с активным
кислородом. Кроме того, эритроциты
используют реакции ПФП для генерирования
больших количеств НАДФН, который
необходим для восстановления глутатиона,
участвующего в системе обезвреживания
активного кислорода, что позволяет
поддерживать нормальную степень
окисления Fe2+ в
гемоглобине.
Снабжение
клеток рибозо-5-фосфатом для синтеза
нуклеотидов, нуклеотидных коферментов
и нуклеиновых кислот. Превращение
рибонуклеотидов в дезоксирибонуклеотиды
также требует НАДФН, поэтому многие
быстро пролиферирующие клетки требуют
больших количеств НАДФН.
Хотя
это не значительная функция ПФП, он
принимает участие в метаболизме пищевых
пентоз, входящих в состав нуклеиновых
кислот пищи и может превращать их
углеродный скелет в интермедиаты
гликолиза и глюконеогенеза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
22.05.201511.34 Mб27Вазопатии. Геморрагический васкулит.Лейкозы Ч2.pdf
- #
- #
Источник
Дано определение молочной кислоты, описана история ее открытия и метаболизм ее превращения в организме при физических нагрузках (цикл Кори). Описывается концепция ацидоза, описывающая изменения в скелетных мышцах, которые приводят к их гипертрофии и увеличению силовых показателей.
Молочная кислота (лактат) и физические нагрузки
Определение
Молочная кислота (лактат) – конечный продукт анаэробного распада глюкозы и гликогена (гликолиза).
История открытия
1780 году шведский химик Карл Вильгельм Шилле выделил молочную кислоту из молока. А в 1808 году Йенс Якоб Берцелиус открыл, что молочная кислота образуется в скелетных мышцах при выполнении физических упражнений.
Молочная кислота и физические нагрузки
Практически при любой физической нагрузке для получения АТФ используется гликоген скелетных мышц. Его концентрация в скелетных мышцах при интенсивных физических нагрузках быстро снижается. Одновременно в скелетных мышцах образуется и накапливается молочная кислота.
Формула молочной кислоты (С3H6O3).
Цикл Кори
Циклический путь метаболизма молочной кислоты в скелетных мышцах открыт американским биохимиком, нобелевским лауреатом Герти Терезой Кори. По другим источникам открытие цикла Кори приписывается нобелевским лауреатом супругам Карлу и Герти Кори. Он описывает превращения молочной кислоты в организме человека. Большая часть молочной кислоты, которая образуется в организме во время физических нагрузок включается в метаболические процессы непосредственно в мышцах и под влиянием фермента лактатдегидрогеназы (ЛДГ) превращается в пировиноградную кислоту, которая затем в митохондриях окисляется до углекислого газа и воды. Другая часть молочной кислоты через кровеносные капилляры проникает в кровь и доставляется в печень, где включается в метаболические реакции, приводящие к синтезу гликогена. Незначительное количество молочной кислоты может выводиться из организма с мочой и потом. Гликоген печени используется организмом для восстановления энергетических источников скелетных мышц.
Концепция ацидоза
Одной из концепций, объясняющей возникновение острых болезненных ощущений, возникающих как во время, так и после тренировки, является предположение, что накопление молочной кислоты в мышечных волокнах является пусковым механизмом целого ряда биохимических реакций.
Во-первых, молочная кислота повышает кислотность внутри мышечных волокон. Изменение рН саркоплазмы мышечных волокон с 7,1 до 6,5 (то есть повышение кислотности) при сильном утомлении снижает активность ключевых ферментов гликолиза – фосфорилазы и фосфофруктокиназы. При значении рН саркоплазмы равном 6,4 расщепление гликогена прекращается. Это вызывает резкое снижение уровня АТФ и развитие утомления (Н.И. Волков с соавт., 2000).
Во-вторых, повышение концентрации молочной кислоты в мышечных волокнах приводит к увеличению проницаемости их мембраны, повышению осмотического давления, в результате чего в мышечные волокна поступает вода. Возникает отёк, мышечные волокна «разбухают» и сдавливают болевые рецепторы мышц. Это ощущается как «жжение» в мышцах (М.И. Калинский, В.А. Рогозкин, 1989). Спортсмены называют это явление «мышцы забиты».
Молочная кислота и лактат
Следует отметить, что молочная кислота и лактат — не одно и то же. Лактат — это соль молочной кислоты. Образовавшаяся в результате гликолиза в скелетных мышцах молочная кислота почти полностью диссоциирует на ионы водорода и соединение, которое соединяется с ионами натрия или калия и образует соль (лактат), рис. 1.
Рис. 1
Поэтому в литературе часто вместо понятия «молочная кислота» используется термин «лактат». Содержание молочной кислоты и лактата имеет взаимосвязь с кислотностью внутри мышечных волокон (то есть с pH саркоплазмы). При pH в интервале от 6.5 (полное утомление) до 7,1 (норма) в мышечных волокнах накапливается, выводится и перерабатывается именно лактат.
В течение нескольких часов лактат удаляется из мышечных волокон. Если после физической нагрузки выполнить 10-15 минутную аэробную работу (например, бег или педалирование на велосипеде), лактат из мышц выведется еще быстрее.
Новые исследования свидетельствуют о том, что основным повреждающим агентом являются ионы водорода (Н+). Утомление в скелетных мышцах вызывает ацидоз — накопление ионов водорода и смещение pH саркоплазмы в кислую сторону (R. A. Robergs et al., 2004).
Молочная кислота, гипертрофия и сила скелетных мышц
Предполагается, что накопление кислых продуктов в мышечных волокнах (ацидоз) лежит в основе их повреждения, что в последствии приводит к их гипертрофии по миофибриллярному типу и росту силы. Следовательно, удалять молочную кислоту из скелетных мышц после тренировки не следует, так как это основной фактор, повреждающий мышечные волокна. Это предположение подтверждается опытом тренировок чемпионки мира в беге на 400 м с барьерами Марины Степановой и ее тренера Вячеслава Владимировича Степанова. Стремясь увеличить силовые показатели мышц ног, М. Степанова и В. Степанов в цикле своих статей «Анаэробика» указывают, что «есть смысл ненадолго (на несколько часов) «повариться» в молочнокислой среде, а «разогнать» ее позже (к примеру, вечерними упражнениями)».
Литература
- Калинский, М.И. Биохимия мышечной деятельности / М.И. Калинский, В.А. Рогозкин. – Киев: Здоровья, 1989.– 144 с.
- Михайлов С.С. Спортивная биохимия. – М.: Советский спорт, 2009.– 348 с.
- Самсонова, А.В. Гипертрофия скелетных мышц человека: Учеб. пособие. 5-е изд. /А.В. Самсонова. – СПб: Кинетика, 2018.– 159 с.
- Самсонова, А. В. Гормоны и гипертрофия скелетных мышц человека: Учеб. пособие. – СПб: Кинетика, 2019.– 204 c.: ил.
- Степанова, М. Анаэробика /М. Степанова, В. Степанов // Легкая атлетика, 2011 № 7-8. С. 24-27.
С уважением, А.В. Самсонова
Источник
Глюконеогенез
— это образование глюкозы вновь
из неуглеводных компонентов: пирувата,
лактата,гликогенных аминокислот,
глицерина,любого соединения, которое
в процессе катаболизма может быть
превращено в пируват или один из
метаболитов цикла Кребса.
Глюконеогенез
протекает в: печени, корковом веществе
почек,слизистой кишечника.За счёт
глюконеогенеза в условиях углеводного
голодания образуется 80 г глюкозы.
Глюконеогенез–это
частично обращённый гликолиз.
Три
реакции гликолиза необратимы, поэтому
используются другие ферменты.
Пируваткиназная реакция заменяется
двумя:пируваткарбоксилазной реакцией
и фосфоенолпируваткарбоксикиназной
реакцией.
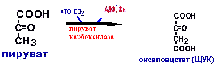

Между
этими реакциями существует челночный
механизм.ЩУК не может самостоятельно
выйти из митохондрий.ЩУК + НАДН+Н =
малат + НАД. В цитоплазме малат окисляется
цитоплазматической малатдегидрогеназой
до ЩУК

От
ФЕП до ФФК реакции все реакции идут в
обратной последовательности
гликолиза:Фосфофруктокиназная реакция
заменяется фруктозодифосфатазной
реакцией.
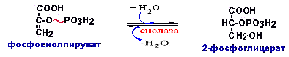
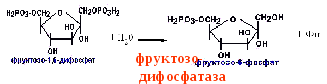
Биологическая
роль глюконеогенезаизбавление от
лактата (85% лактата идёт на глюконеогенез,
15% — окисляется до СО2, Н2О и энергии),
связь обменов, получение эндогенной
глюкозы.
Итоговое
уравнение глюконеогенеза
2
лактата + 6АТФ + 4Н2О + 2НАДН+Н глюкоза
+ 6АДФ + 6Фн + 2НАД
АТФ
используется в пируваткарбоксилазной,
фосфоенолпируваткарбоксикиназной,
фосфоглицераткиназной реакциях. НАДН+Н
необходим для ГАФДГ. 2Н20 участвуют в
енолазной реакции. 2Н20 – в фосфатазных
реакциях.
Регуляция
глюконеогенеза4 фермента определяют
скорость процесса. При уменьшении АТФ
и НАД тормозится глюконеогенез. Ключевые
ферменты стимулируются АТФ,ингибируются
– АДФ и АМФ. Инсулин – репрессор ферментов
глюконеогенеза.Процесс активируется:
глюкокортикоидами, жирными кислотами,
избытком лактата в крови, глюкагоном.
Цикл
Кори
осуществляет связь между
гликолизом в мышце при активной работе
и глюконеогенезом в печени. При работе
лактат поступает из мышц в кровь и
печень.

Мышца
Кровь
Печень
3)Больной 50 лет поступил в клинику с жалобами на резкие боли в области сердца, слабость. Активность каких ферментов следует определить в крови больного для исключения инфаркта миокарда?
МБ+КФК
ЛДГ
АСТ/АЛТ
Миоглобин
тропонин
Билет
23
1)Холестерин, его биологическая роль, биосинтез. Гиперхолестеринемии. Атеросклероз.
Холестерин:
циклический
ненасыщенный спирт,нерастворим
в воде,в
основе холестерина лежит кольцо
циклопентанпергидрофенантрена.
Содержится
в: коре надпочечников, мозге, нервной
ткани, мышцах, соединительной ткани,
жировой ткани.
Биороль:
синтез
желчных кислот,синтез
половых гормонов,синтез
кортикостероидов,синтез
витамина D3,входит
в состав клеточных мембран, миелиновых
оболочек,участвует
в образовании желчных камней, развитии
атеросклероза.
Пищевые
источники холестерина:
печень,
яйца,
мясо,
мозг,
икра.
Синтезируется
в:
эндоплазматическом
ретикулуме, цитозоле печени (80%),
коже,
стенке
тонкой кишки.
Синтез
холестерина:
включает
35 реакций,идёт
в 3 стадии:
образование
из ацетил-КоА мевалоновой кислоты,образование
из мевалоновой кислоты сквалена,циклизация
сквалена в холестерин.
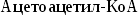
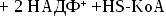
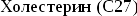
Холестеринемии:
1)Наследственная.
В
сыворотке крови увеличено содержание
холестерина, β-липопротеинов
Механизм
развития заболевания– отсутствие
или снижение количества рецепторов
клеток к ЛПНП, снижается захват и
катаболизм холестерина из ЛПНП,
увеличивается содержание холестерина
в плазме, оседание холестерина на стенки
сосудов, развитие атеросклеротических
бляшекОсложнения– ранний инфаркт миокарда, ксантоматоз,
инсульт
2)
Алиментарная гиперхолестеринемиявозникает от избытка в питании холестерина
3)Вторичная
гиперхолестеринемиявозникает
при гипотиреозе, сахарном диабете,
подагре, нефротическом синдроме
Атеросклероз:
Заболевание,
связанное с накоплением холестерина
в интиме сосудов с последующей
дегенерацией, отложением в очаг поражения
солей кальция, фиброзированием очага
и тромбозомДиагностические
критерии:гиперлипидемия,
гиперхолестеринемия
изменение
состава и соотношения транспортных
форм холестерина (увеличение ЛПНП и
уменьшение ЛПНП)Снижение
соотношения фосфолипиды
холестерин
Снижение
активности липопротеинлипазыУменьшение
в составе триацилглицеринов
полиненасыщенных жирных кислот и эфиров
холестерина
Способствуют
развитию атеросклероза:
наследственная
предрасположенность
гипертония
сахарный
диабет
ожирение
стрессы
гиподинамия
нарушение
равновесия свертывающей и противосвертывающей
системы крови.
Соседние файлы в предмете Биохимия
- #
- #
Источник