Биологическая терапия при язвенном колите

“Препараты, полученные в результате генной инженерии” – страшновато звучит, не правда ли?
Множество больных неспецифическим язвенным колитом вынуждены на протяжении практически всей жизни принимать лекарства. Как правило, спектр препаратов ограничивается различными форматами 5-АСК (таблетки, гранулы, ректальные свечи, пена), но в сложных случаях дело может дойти и до гормонов с цитостатиками. И вот когда все это не помогает, а становится только хуже, больному НЯК могут предложить следующие варианты развития событий: удалить часть/весь толстый кишечник, тем самым полностью излечив его от неспецифического язвенного колита, или попробовать войти в ремиссию, прибегнув к биологической терапии.
Что же такое генная инженерия? Это совокупность методов и технологий (в т.ч. технологий получения РНК и ДНК) по “вычленению” генов из организма, осуществлению манипуляций с этими генами и введению их в другие организмы.
Ремикейд (Infliximab), Хумира (Adalimumab), Симпони (Golimumab), Энтивио (Vedolizumab) – те самые продукты генной инженерии, которые официально одобрены для применения в лечении НЯК, БК и других аутоиммунных заболеваний. Прочесть о моем опыте использования Ремикейда вы сможете в соответствующей статье, дабы я здесь не повторялся.
Ремикейд, Хумира, Симпони и Энтивио – препараты в высшей степени серьезные, назначать их себе самостоятельно нельзя ни при каком условии! Они могут помочь вам войти в ремиссию: исчезнут типичные симптомы НЯК (диарея, кровь в кале, боли в животе), эндоскопическая картина толстого кишечника придет в норму. Но, как вы уже догадались, есть и обратная сторона медали.
Вот лишь небольшой перечень возможных побочных эффектов (без разбивки на препараты, т.к. в целом у вышеперечисленных лекарств они идентичны):
- Головокружение.
- Тахикардия.
- Аллергия.
- Диарея/запор.
- Конъюктивит.
- Вирусные/паразитарные/бактериальные инфекции.
- Псориаз.
- Анафилактический шок.
- Туберкулез.
- Лимфома.
- Лейкоз.
- Сепсис.
Помимо вышеупомянутой причины рекомендации биологический терапии, поводом может служить невозможность пациента отказаться от приема глюкортикоидов: зачастую, у больных наблюдается дозозависимый эффект. Проявляется он в возобновлении первичной симптоматики НЯК после снижения дозировки гормонов до определенного уровня, что приводит к невозможности полностью отказаться от их использования. Про то, какой вред нанесли мне гормоны в период их применения, можете узнать из этой статьи. У меня есть знакомая, которой многолетний прием глюкортикоидов принес более серьезную проблему – аутоиммунный сахарный диабет.
ФНО-α (фактор некроза опухоли-альфа) – это внеклеточный белок, естественный цитокин, который принимает участие в регуляции нормального воспалительного и иммунного ответа. В организме синтезируется в основном моноцитами и макрофагами. Активирует лейкоциты, и, соответственно, входящие в них лимфоциты – главные клетки иммунной системы, обеспечивающие выработку антител против патогенных организмов. Логичный вывод: чтобы снизить активность иммунитета (если причина вашего НЯК кроется в аутоагрессии), необходимо подавлять ФНО-α. Каковы же принципы работы Ремикейда, Хумиры, Симпони и Энтивио?
Ремикейд (Infliximab)
Является химерным мышино-человеческим моноклональным антителом, которое с высоким сродством связывается с растворимой и трансмембранной формами ФНОα, но не связывается с лимфотоксином альфа (ЛТα).
Хумира (Adalimumab)
Является рекомбинантным моноклональным антителом, пептидная последовательность которого идентична IgG1 человека. Селективно связывается с ФНО-α и нейтрализует его биологические функции за счет блокады взаимодействия с поверхностными клеточными р55 и р75 рецепторами к ФНО-α.
Симпони (Golimumab)
Является человеческим моноклональным антителом класса IgG1, которое вырабатывается линией клеток мышиной гибридомы с применением технологии рекомбинантной ДНК. Образует высокоаффинные, стабильные комплексы “антиген-антитело” как с растворимыми, так и с трансмембранными биоактивными формами ФНОα человека, предотвращая связывание оного с его рецепторами.
Энтивио (Vedolizumab)
Является гуманизированным моноклональным антителом, которое путем связывания с белком клеточной мембраны интегрин-альфа-4-бета-7 блокирует миграцию лейкоцитов в слизистую оболочку кишки. Препарат назначается людям, не ответивших на лечение антагонистами ФНОα.
Моноклональные антитела – это антитела, вырабатываемые иммунными клетками, принадлежащими к одному клеточному клону, то есть произошедшими из одной плазматической клетки-предшественницы.
Проще говоря, если название препарата оканчивается на -mab, значит, вероятнее всего, в его основе лежат моноклональные антитела (“monoclonal antibody”).
Глядя на вероятные побочные эффекты приведенных в жтой статье лекарств, многие отчаиваются. Я вас прекрасно понимаю, друзья! В 2013-м году я долго думал, все взвешивал, проходил через стадии принятия и отторжения заболевания. Риск, как говорится, дело благородное, и этот случай не исключение.
Если положение дел таково, что врач вам предлагает либо продолжать “сидеть” на гормонах, либо операцию, либо биологическую терапию, то, мой вам совет: откажитесь, по-крайней мере, от пожизненного приема глюкортикоидов. Вред, который они очень быстро наносят организму, мало с чем можно сравнить.
Многих интересует вопрос беременности. Да, родить здорового ребенка будет вполне возможно! Моя врач мне говорила, что за два месяца перед зачатием необходимо прекратить терапию Ремикейдом. Однако, в развитых странах (США, Италия, Германия, Франция и др.) известны случаи рождения вполне здоровых деток даже на двойной(!!!) дозе препарата.
Операция или биологическая терапия? Выбор, поистине, чрезвычайно тяжелый. Вероятно, самый сложный в вашей жизни. Оцените все риски, обговорите все со своим доктором и примите единственно верное решение.
Источник
 Таблетки и флаконы
Таблетки и флаконыПо данным отчета Spherix Global Insights RealWorld Dynamix, в 2017 году больные с воспалительным заболеванием кишечника (ВЗК) чаще меняют биологическую терапию, чем в 2016 году.
Согласно выводам, появление биологического лекарства Стелара (Stelara, ustekinumab) производства Janssen, одобренного в прошлом году для лечения болезни Крона (БК), резко повлияло на тенденцию смены выбранной схемы терапии.
В работу были включены более 1000 медицинских записей пациентов с язвенным колитом (НЯК) и болезнью Крона, которые в ходе лечения отдали свое предпочтение биологическим препаратам. В обзоре приняли участие 187 гастроэнтерологов. Биологический препарат – это лекарство, в основе которого лежат те или иные элементы живого происхождения.
В докладе показано, что препарат Стелара, блокирующий воспалительные молекулы IL-12 и IL-23, теперь является наиболее предпочтительным лекарством «второй линии», который не нацелен на фактор некроза опухоли (ФНО). Энтивио (Entivio, vedolizumab) производства Takeda в прошлом году был лидером среди подобного рода лекарств. Фактор некроза опухоли – это внеклеточный белок, многофункциональный провоспалительный цитокин, синтезирующийся в основном моноцитами и макрофагами и участвующий в ряде аутоиммунных заболеваний, включая ВЗК.
Подавление ФНО является наиболее популярным методом лечения воспалительных заболеваний кишечника. Многим пациентам, в случае отсутствия ответа на лечение одним из таких препаратов (например, небезызвестным Ремикейдом), взамен назначается сходное по действию лекарство, которое также блокирует ФНО (например, Хумира).
Но с конца 2016 года ситуация поменялась: все больше врачей в качестве следующих этапов лечения назначают пациентам с ВЗК препараты так называемой «второй линии», которые нацелены на другие молекулы, а не на ФНО.
В соответствии с докладом, основной причиной, по которой гастроэнтерологи рекомендуют пациентам сменить терапию, выступает отсутствие у последних значимой положительной динамики. По данным исследования, 70% пациентов, не ответивших в течение 6 месяцев на лечение блокаторами ФНО, переводятся на Энтивио или Стелару.
На данный момент Стелара признана мировым научным сообществом для лечения БК. Однако, врачи практикуют ее использование и в отношении пациентов с НЯК.
Несмотря на то, что Энтивио занимает пальму первенства среди препаратов второй линии, в докладе прогнозируется, что в скором времени Стелара станет выбором почти трети пациентов, которые вынуждены были уйти с Ремикейда, Хумиры или Симпони.
Многие из гастроэнтерологов, участвовавших в докладе, заявили, что пациенты часто принимают активное участие в решении о смене терапии и иногда выступают в качестве решающего фактора.
У врачей повышается потребность в сокращении времени, требуемого для получения разрешения на смену препаратов. Гастроэнтерологи более склонны пробовать лекарства нового способа действия, отступая от старых блокаторов ФНО.
Практически 50% людей с НЯК или БК не отвечают на лекарства стандартной терапии, к которым относятся месалазины, цитостатики и стероиды. Это факт побуждает ученых изобретать препараты нового поколения, включая Xeljanz (tofacitinib citrate), Mongersen (celgene), Ozanimod и Etrolizumab.
Источник
Статья посвящена оптимизации биологической терапии язвенного колита препаратом голимумаб
Язвенный колит (ЯК) – хроническое заболевание толстой кишки, характеризующееся иммунным поражением слизистой оболочки, сопровождающееся ее воспалением, отеком и образованием язвенных дефектов, проявляющееся кровавой диареей и болями в животе.
Хотя основной механизм воспаления при ЯК остается не совсем ясным, доклинические и клинические исследования продемонстрировали, что фактор некроза опухоли альфа (ФНО-α) играет ключевую роль в патогенезе ЯК, установлено, что именно неконтролируемая гиперпродукция этого цитокина лежит в основе хронизации иммунопатологического процесса [1]. Одно из наиболее ярких достижений фармакотерапии воспалительных заболеваний кишечника (ВЗК) связано с разработкой принципиально новой группы лекарственных средств – генно-инженерных биологических препаратов (ГИБП) («biologic» agents) [2]. В настоящее время к ним относят несколько полученных биотехнологическим путем препаратов: моноклональные антитела (мАТ) против определенных медиаторов, продуцируемых иммунокомпетентными клетками, или «провоспалительных» цитокинов, рекомбинантные «противовоспалительные» цитокины и естественные ингибиторы цитокинов (растворимые рецепторы, антагонисты) [2].
ГИБП, совершившие революцию в терапии ВЗК, получают все более широкое распространение в лечении больных ЯК и болезнью Крона (БК). В настоящее время в России зарегистрировано три ГИБП, являющихся анти-ФНО-α-препаратами, для лечения ЯК – инфликсимаб, голимумаб и адалимумаб. Наибольший опыт применения инфликсимаба (ИФЛ) показывает, что, несмотря на высокую эффективность препарата, у части больных ВЗК (до 20–30%) не удается достигнуть клинического улучшения (первичная неэффективность) или же у них развивается приобретенная лекарственная резистентность (вторичная неэффективность, вторичная потеря ответа). Потребность в интенсификации дозы составляет 3,9% случая на пациента в месяц при ЯК и 1,4% – при БК [3]. Вторичная потеря ответа на ИФЛ отмечается в 15% случаев при ЯК [4]. При БК ежегодный риск потери ответа составляет 13% для ИФЛ и 24% для адалимумаба (АДА) [5, 6]. Следует отметить, что на развитие вторичной потери ответа на антицитокиновую терапию влияют следующие причины: нерегулярность введения препарата, монотерапия моноклональными антителами, исходно высокий уровень ФНО-α и низкий уровень альбуминов, а также наличие антител к препарату [7].
В процессе лечения больного ЯК с использованием ИФЛ перед врачом рано или поздно могут встать вопросы: каковы причины вторичной потери ответа, каковы способы дальнейшего ведения больного при развитии вторичной потери ответа на ИФЛ?
Согласно последним исследованиям, в числе причин вторичной потери ответа могут быть активация оппортунистической инфекции [8], а также изменение патогенеза заболевания по мере его прогрессирования с уменьшением роли ФНО-α и сдвигом баланса в сторону других провоспалительных цитокинов [7]. Вероятнее всего, вторичная неэффективность анти-ФНО-α-терапии напрямую связана с потенциальной иммуногенностью ГИБП, а образовавшиеся антитела к ГИБП могут снизить эффективность биопрепаратов и/или вызвать неблагоприятные события. В многочисленных клинических исследованиях продемонстрировано, что все ГИБП обладают иммуногенностью, не зависящей от структуры молекулы ингибиторов ФНО-α [9]. Персонализированный мониторинг заболевания в целях улучшения его контроля, а также, учитывая высокую стоимость ингибиторов ФНО-α, мониторинг концентрации ИФЛ и антител к инфликсимабу позволят повысить экономический эффект от терапии ГИБП.
Путями преодоления вторичной неэффективности, в зависимости от остаточного уровня препарата в крови и наличия/отсутствия антител, являются: оптимизация терапии, включающая увеличение дозы препарата и сокращение интервалов между инфузиями; дополнительное назначение иммуносупрессоров или переход на другой анти-ФНО-α-препарат [10]. В настоящее время появилась возможность перевода больного ЯК на новый анти-ФНО-α – голимумаб (ГЛМ).
ГЛМ – полностью человеческое моноклональное антитело к ФНО-α, обладающее высокой аффинностью к ФНО-α и стабильностью молекулы, что обеспечивает его высокую эффективность и более низкую иммуногенность. Препарат обладает таким же сродством к трансмембранному ФНО-α, как и все препараты, относящиеся к данной группе, но бо’льшим сродством к растворимому ФНО-α [11]. ГЛМ одобрен для клинического использования в Евросоюзе и США в 2009 г., в России зарегистрирован в мае 2012 г.
В исследовании PURSUIT-SC больные ЯК, рефрактерные к стандартной терапии, были рандомизированы на группы, принимающие плацебо или ГЛМ, который назначался с целью индукции ремиссии в 2-х режимах: в дозе 400 мг и 200 мг или 200 мг и 100 мг. Через 6 нед. терапии доля пациентов, достигших клинической ремиссии, среди получавших ГЛМ составила 17,8%, а в группе плацебо – 6,4%. Заживление слизистой на 6-й нед. наблюдалось у 45,1 и 28,7% больных соответственно [12]. Пациенты, ответившие на индукционную терапию ГЛМ, были рандомизированы в исследуемые группы по поддержанию ремиссии и получали в течение 52 нед. ГЛМ (50 мг или 100 мг каждые 4 нед.) или плацебо. В группе больных, принимающих ГЛМ, длительность ремиссии наблюдалась в 49,7% случаев, в группе плацебо – в 31,2%, а достижение заживления слизистой – у 42,4 и 26,6% больных соответственно [12]. Высокая частота поддержания клинической ремиссии в группе плацебо (31%) объясняется особенностью дизайна исследования, согласно которому все пациенты группы плацебо получили индукцию ГЛМ и ответили на нее. Последующая отмена препарата и переход на плацебо позволили оценить безрецидивный период после проведения индукционного курса. Результаты показали, что при проведении только индукции без последующего поддерживающего курса ремиссия сохраняется в течение 6 мес. Следует также подчеркнуть уникальность дизайна этого исследования, предусматривавшего жесткий контроль эффективности ГЛМ, который включал 15 этапов промежуточной оценки (например, оценка эффективности ИФЛ в исследовании АCT1 предполагала только 2 этапа, а в исследовании ACT2 – 3 этапа). Этой особенностью объясняется не очень высокая, в сравнении с ИФЛ, частота заживления слизистой оболочки (45,1%). Анализировалась эффективность исследования, включая заживление слизистой оболочки, лишь у тех пациентов, кто продемонстрировал полный клинический ответ на всех 15 этапах оценки. Если пациент не удовлетворял критериям клинического ответа хотя бы на одном этапе оценки, то он не учитывался в финальном анализе эффективности.
Результаты этих исследований позволяют рекомендовать ГЛМ для лечения ЯК, поскольку он не только эффективен, но и удобен в применении и имеет хороший профиль безопасности [13]. До сих пор не проводились прямые исследования, сравнивающие эффективность ИФЛ и ГЛМ у больных ЯК. Преимущество ГЛМ перед ИФЛ (вводится внутривенно) заключается в облегченном режиме приема – подкожное введение, с интервалом в рамках поддерживающей терапии 4 нед. Кроме того, имеются данные о значительно более низкой иммуногенности ГЛМ. При выборе биологического препарата для лечения ЯК рекомендуется учитывать вопросы стоимости терапии, пожелания пациента относительно способа введения, а также профиль безопасности и эффективности. Пациентов, не отвечающих на предшествующую терапию, рекомендуется переводить с одного анти-ФНО-α-препарата на другой. Если применение более двух анти-ФНО-α-препаратов не позволяет достичь адекватного ответа и/или вызывает непереносимость, то рекомендуется переход на биологические препараты с другим механизмом действия [13].
АДА зарегистрирован в России для лечения ЯК только в сентябре 2015 г., поэтому отсутствуют клинический анализ применения АДА и результаты терапии ЯК в реальной клинической практике в нашей стране.
В отделе патологии кишечника МКНПЦ ДЗМ проводятся клинический анализ результатов лечения больных ЯК и БК, получающих терапию ГИБП, изучение механизмов возникновения первичной и вторичной неэффективности антицитокиновой терапии, а также поиск путей их преодоления.
Целью нашей работы являлся клинический анализ результатов лечения больных ЯК с применением ГЛМ, а также эффективности и безопасности этой терапии.
Материал и методы
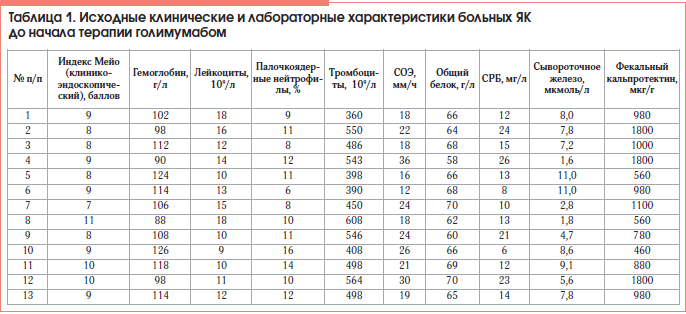
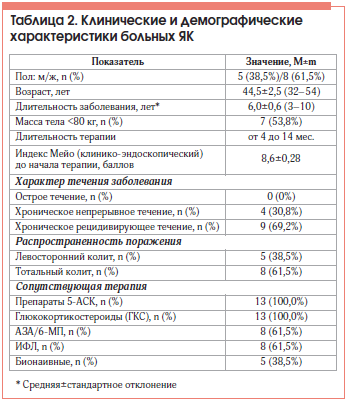
Обследовано 13 больных ЯК, получавших ГЛМ, из них 5 (38,5%) мужчин и 8 (61,5%) женщин. Средний возраст больных составил 44,5±2,5 года (от 32 до 54 лет). Большинство больных – 12 (92,3%) были со среднетяжелой степенью заболевания. Основные клинические, лабораторные и демографические характеристики пациентов представлены в таблицах 1 и 2.
Внекишечные проявления имели 10 (76,9%) больных ЯК: 6 (46,1%) – артралгии/артропатии, 1 (7,7%) – узловатую эритему, 1 (7,7%) – гангренозную пиодермию, 1 (7,7%) – анкилозирующий спондилоартрит и 1 (7,7%) – сочетание полиартропатии и узловатой эритемы.
ГЛМ вводили по схеме: индукционная доза – 200 мг п/к, затем 100 мг через 2 нед. и далее поддерживающий курс – 100 или 50 мг каждые 4 нед. в зависимости от массы тела (более или менее 80 кг соответственно). Время наблюдения за пациентами составило 52 нед. Эффективность терапии оценивали по полному индексу Мейо (клинико-эндоскопическому), СОЭ, лейкограмме, уровню гемоглобина, лейкоцитов, тромбоцитов, общего белка, СРБ, сывороточного железа, фекального кальпротектина, с интервалом 12, 26 и 56 нед.
Результаты и обсуждение
Причинами отмены ИФЛ у больных ЯК послужили возникшие осложнения. У 2 (15,4%) больных отмечались острые тяжелые инфузионные реакции на введение ИФЛ (бронхоспазм, анафилаксия) в связи с нарушением схемы введения препарата. Интервал между введениями ИФЛ составил больше 4 мес. В 1 (7,7%) случае причиной отмены ИФЛ послужила беременность, и еще в 1 (7,7%) случае отказ больной от дальнейшего введения ИФЛ объяснялся клинико-эндоскопической ремиссией. У 4 (30,7%) больных ЯК развилась вторичная потеря ответа на ИФЛ после оптимизации терапии (увеличение дозы до 10 мг/кг или уменьшение интервала введения до 4 нед.). У 1 (7,7%) больного с тяжелой степенью заболевания, которому ИФЛ был назначен как альтернатива колэктомии, впоследствии развилась вторичная потеря ответа на ИФЛ.
Течение ЯК у пациентов после начала терапии ГЛМ
После проведения индукционного курса 12 из 13 пациентов ответили на терапию и продолжили поддерживающее лечение ГЛМ по схеме. Не ответил на индукционную терапию ГЛМ 1 (7,7%) больной. Ему была выполнена плановая колэктомия в связи с прогрессирующим ухудшением состояния: продолжавшейся кровавой диареей, анемией, лейкоцитозом, повышенным уровнем СРБ, СОЭ и прокальцитонина.
Через 12 нед. у 9 (69,2%) из 12 больных, ответивших на терапию ГЛМ, достигнута клиническая ремиссия, у 3 (23,1%) – клинико-эндоскопическая ремиссия. Индекс Мейо в группе в среднем снизился с 8,6±0,28 до 1,8±0,37 балла. Динамика основных лабораторных показателей представлена в таблице 3.
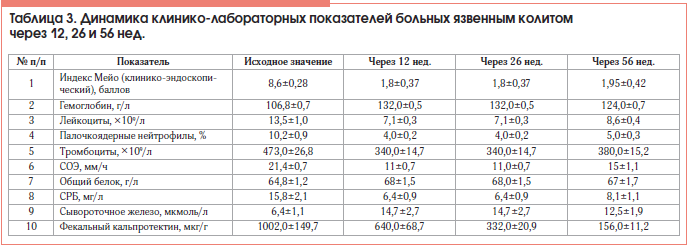
Через 26 нед. мы провели интегрированный анализ исследования индукционной и поддерживающей терапии ГЛМ больных ЯК, как бионаивных, так и получавших ГИБП ранее. Поддерживающая фаза следовала сразу за индукционной. Индекс Мейо в группе сохранялся на уровне 1,8±0,37 балла. Количество больных с заживлением слизистой оболочки кишки увеличилось до 6. Таким образом, клинико-эндоскопическая ремиссия достигнута у 50% больных ЯК, как у бионаивных, так и у получавших ранее ИФЛ. Основные клинико-лабораторные показатели в среднем оставались в пределах референсных значений (табл. 3).
Через 10 мес. от начала терапии ГЛМ у 1 больного (8,3%), достигшего клинической ремиссии ЯК, ранее получавшего ИФЛ, произошел рецидив заболевания: индекс Мейо повысился до 10 баллов, частота стула – до 8 раз в сутки, с примесью крови; гемоглобин снизился до 100 г/л; СОЭ составила 36 мм/ч; содержание лейкоцитов – 13×109/л, тромбоцитов – 555×109/л, СРБ – 21 мг/л, сывороточного железа – 8 мкмоль/л, фекального кальпротектина – >1800 мкг/г. Больному назначена терапия ГКС в рекомендуемых дозах.
Таким образом, через год от начала терапии ГЛМ клиническая ремиссия сохранялась у 5 (41,6%) больных из 12, ответивших на терапию, клинико-эндоскопическая ремиссия – у 6 (50,0%). Следует отметить, что среди бионаивных пациентов все 5 сохраняли ремиссию заболевания в течение года, в то время как рецидив ЯК и отсутствие ответа отмечались у 2 (15,4%) пациентов, ранее получавших ИФЛ. Однако сравнение частоты рецидива среди бионаивных пациентов и больных ЯК, получавших ИФЛ, не выявило статистической достоверности (р=0,45) вследствие небольшого количества наблюдений.
У 6 (60,0%) больных, ответивших на терапию ГЛМ, также отмечался регресс внекишечных проявлений: уменьшение интенсивности артралгий, регресс гангренозной пиодермии, узловатой эритемы. Однако у 2 (16,6%) больных ЯК сохранялись проявления анкилозирующего спондилоартрита и артропатии.
За год наблюдения не было отмечено ни одного случая тяжелых и нетяжелых инфекционных осложнений, обострения хронических воспалительных заболеваний.
Заключение
Появление в настоящее время в арсенале гастроэнтерологов России нового анти-ФНО-α-препарата – голимумаба – расширило возможности лечения больных ЯК в случае развития вторичной потери ответа на терапию анти-ФНО-α-препаратами или нежелательных реакций на ИФЛ. Приведенный нами анализ также продемонстрировал, что ГЛМ хорошо переносится пациентами с развившимися нежелательными явлениями на ИФЛ в виде анафилаксии. Это обусловлено тем, что ГЛМ является полностью человеческим ингибитором ФНО-α, а его низкая иммуногенность связана с особенностями строения молекулы и отсутствием необходимости направленного мутагенеза, как того требует, например, АДА [14].
ГЛМ с его отличительными свойствами открывает новые возможности в лечении больных ЯК. Многочисленные исследования подтверждают его низкую иммуногенность по сравнению с аналогичными генно-инженерными биологическими препаратами, а также отсутствие связи между наличием антител к ГЛМ и потерей клинической эффективности [10]. ГЛМ является новым, эффективным ингибитором ФНО-α, применение которого может способствовать оптимизации терапии ЯК. Применение ГЛМ при ЯК подтвердило международные данные о его эффективности в достижении клинического ответа, индукции клинической ремиссии, способности к заживлению слизистой оболочки кишки и поддержании ремиссии заболевания.
Источник

