Цпд для вируса кори
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла.
Частичная дегенерация культур клеток может протекать по следующим типам:
— гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
— очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
— симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респираторно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).
Если в инфицированных культурах клеток ЦПД отсутствует или слабо выражено, проводят «слепые пассажи», т.е. заражают культуральной жидкостью новые культуры клеток.
А б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса) х 200
Индикация вирусов с помощью реакции гемадсорбции (РГад).
Сущность этой реакции заключается в способности эритроцитов человека или животных адсорбироваться на поверхности клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 40, 200 или 370 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе.
Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям.
Репродукция некоторых вирусов (оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому — Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
Индикация вирусов с помощью прямой РИФ – выявлениевирусных антигенов, находящихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применяется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х 900
Индикация вирусов по образованию бляшек — очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большинства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах.
Зараженные РКЭ инкубируют в термостате при 35- 370 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри. При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки — беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов — поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
РГА ставят обычно в пробирках или в специальных полистироловых планшетах. Для этого готовят двукратные разведения вирусосодержащего материала на ФР в объеме 0,5 мл. Во все пробирки добавляют 0,5 мл 1% взвеси эритроцитов. В контроле к 0,5 мл ФР добавляют аналогичный объем взвеси эритроцитов. Пробы учитывают через 30-60 мин инкубации при комнатной температуре, в термостате при 370 С или в холодильнике при 40 С. Положительная реакция характеризуется выпадением осадка эритроцитов в виде «зонтика» с фестончатыми краями; при отрицательном результате эритроциты оседают в виде компактного осадка («пуговки» — рис. 31).
Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов — одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке.Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 24-72 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от вируса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов проводится с помощью следующих методов.
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сыворотками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вирус-содержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вирус-сыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН — отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49 — сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте — подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вирус-содержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 370 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку.
Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 370 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН — 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН — ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Реакция торможения гемаггяютинации (РТГА) является одним из вариантов РН и основана на нейтрализации гемагглютинирующих свойств вирусов специфическими антителами, что проявляется отсутствием агглютинации чувствительных эритроцитов с формированием на дне пробирки или лунки полистиролового планшета компактного осадка вместо «зонтика». РТГА используется как для определения антител в качестве метода серологической диагностики, так и для идентификации вирусов, обладающих гемагглютининами. Феномен РТГА проявляется в образовании компактного осадка эритроцитов вместо «зонтика» гемагглютинации.
Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к двукратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (40, 200, 370 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
— выявление вирусной НК методами генодиагностики с помощью метода молекулярной гибридизации и ПЦР;
— электронно-микроскопическое изучение вирусов (см. выше).
Дата добавления: 2015-05-26; просмотров: 17925; Опубликованный материал нарушает авторские права? | Защита персональных данных
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9758 — | 7460 — или читать все…
Читайте также:
Источник
Для выявления
(индикации) вирусов применяются следующие
методы.
Индикация вирусов
в культуре клеток осуществляется,
прежде всего, по цитопатическому действию
(ЦПД) вирусов, сроки и характер которого
зависят от свойств вируса, проявляясь
дегенеративными изменениями клеток с
последующей их гибелью и отслаиванием
от стекла (рис. 29).
Полная дегенерация
клеток сопровождается значительными
изменениями в виде пикноза ядра и
цитоплазмы, отслаиванием клеточного
монослоя от стекла. Частичная
дегенерация
культур клеток может протекать по
следующим типам:
гроздеобразования
(округление, увеличение и слияние клеток
с
образованием гроздевидных
скоплений, типично для аденовирусов),
очаговой
деструкции (очаги
пораженных клеток
на фоне в целом сохранившегося монослоя),
характерной
для вирусов гриппа;
симпластообразования
(слияние клеток с
образованием гигантских многоядерных
клеток
в виде симпластов или синцитиев,
характерных для вирусов кори, паротита,
парагриппа, респираторно-синцитиального,
герпеса, иммунодефицита
человека).
Пролиферативный
тип ЦПД с трансформацией клеток в
злокачественные, обладающие неограниченными
потенциями к росту, способны вызывать
онкогенные вирусы.
Сроки, в течение
которых наступает ЦПД, вариабельны
(например, 1-2 дня у полиовирусов, 7-14 суток
у аденовирусов).
Если
в инфицированных культурах клеток ЦПД
отсутствует или слабо
выражено, проводят «слепые пассажи»,
т.е. заражают культуральной
жидкостью новые культуры клеток.
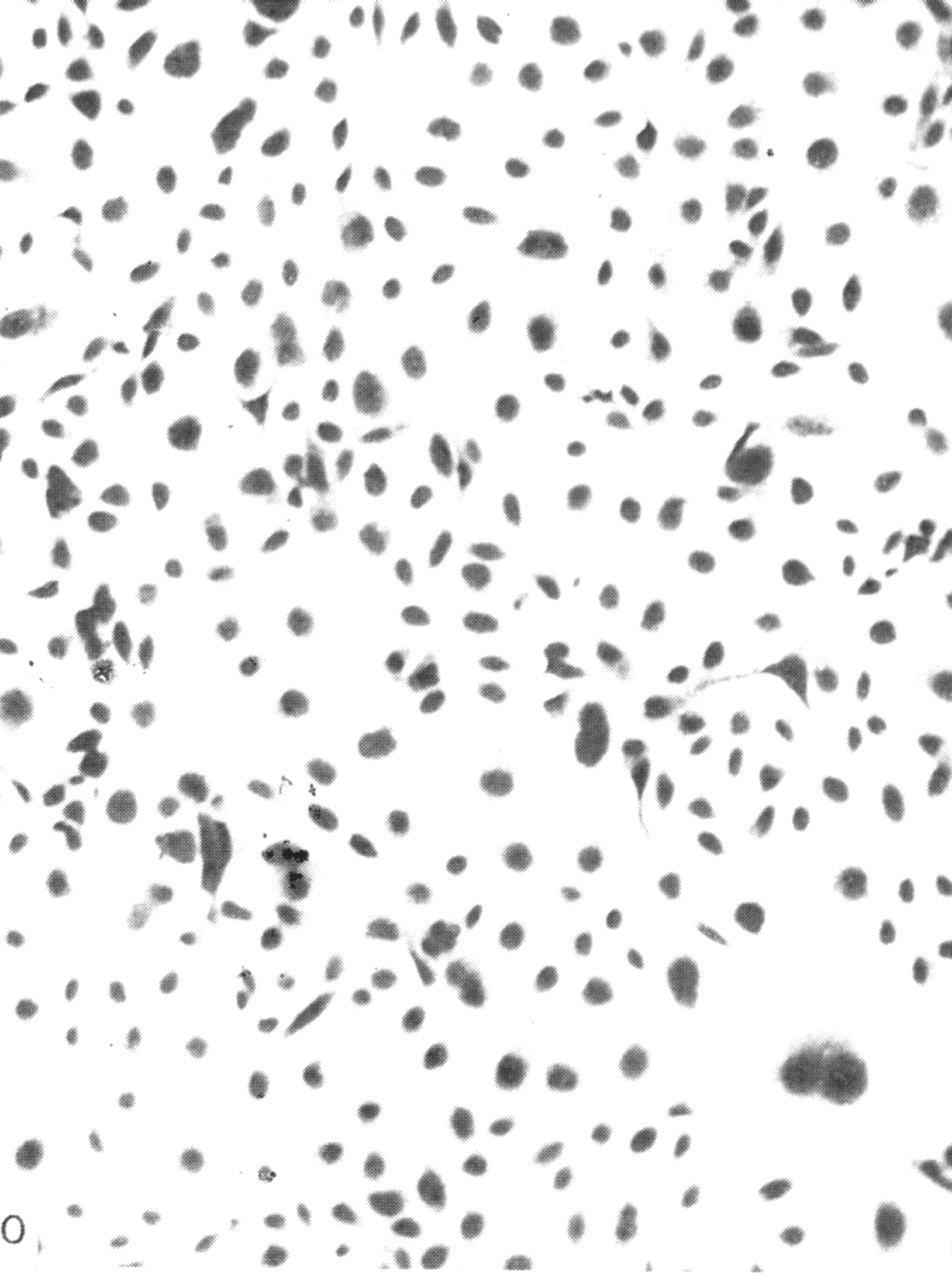
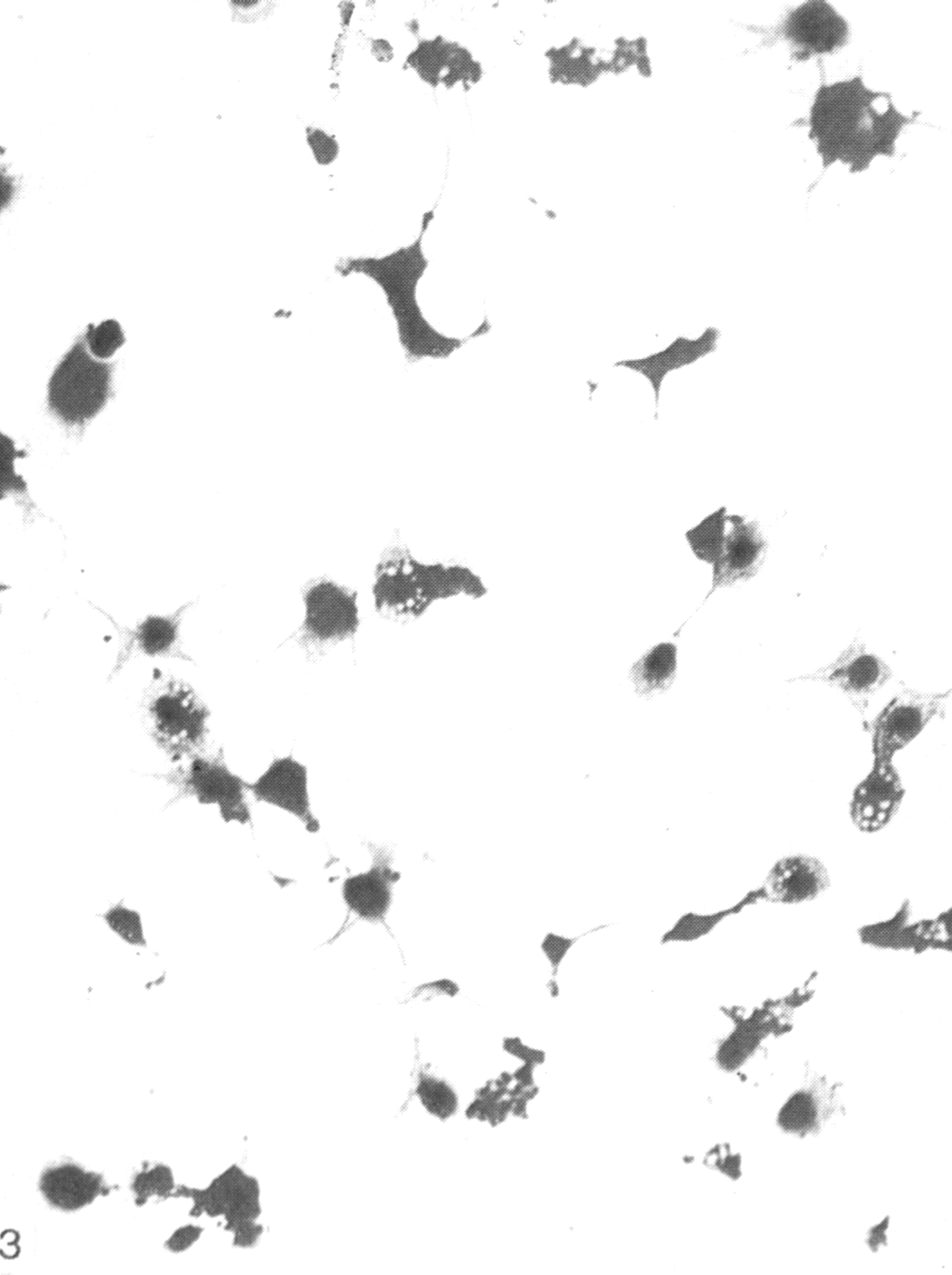
а б
Рис.
29. Культура клеток почек обезьян (а –
незараженная, б – цитопатическое
действие вируса) х200
Индикация
вирусов с помощью реакции гемадсорбции
(РГад). Сущность
этой реакции заключается в способности
эритроцитов человека или животных
адсорбироваться
на
поверхности клеток, инфицированных
рядом вирусов (например, орто и
парамиксовирусов и др.) в ранние сроки
их репродукции (до
развития ЦПД) в результате действия
гемагглютининов – гликопротеидов,
входящих в состав
суперкапсида
вируса. Для
постановки РГад в культуру клеток
добавляют
0,2 мл 0,5%-й
взвеси эритроцитов, выдерживают 15-20
мин при температуре 40,
200
или 370
С в зависимости от свойств вируса, после
чего взвесь эритроцитов удаляют и
производят учет реакции под малым
увеличением
микроскопа по скоплению эритроцитов
на отдельных клетках или на всем монослое.
Индикация
вирусов по цветной пробе.Принцип
метода основан на определении кислых
продуктов метаболизма, накаливающихся
в клетке в процессе ее жизнедеятельности
с помощью индикатора фенолового красного,
меняющего свой цвет с красного в щелочной
среде на оранжево-желтый в кислой среде.
При
заражении культуры клеток
вирусами, вызывающими ЦПД (например,
аденовирусы, энтеровирусы и др.),
метаболизм
клеток подавляется, рН среды не меняется
и она
остается окрашенной в красный цвет.
Индикация
вирусов по внутриклеточным включениям.
Репродукция
некоторых вирусов (оспы, герпеса,
бешенства) приводит к образованию внутриклеточных
включений,
локализующихся в
цитоплазме
или в ядре клеток и представляющих
собой скопления вируса (или его антигенов).
Включения
выявляют путем световой микроскопии
культур клеток, окрашенных
по Романовскому- Гимзе или другими
методами,
а также с помощью прямого флюорохромирования
(например акридиновым оранжевым) с
последующей микроскопией препаратов
в люминесцентном микроскопе.
Индикация
вирусов с помощью прямой РИФ – выявлениевирусных
антигенов, находящихся в инфицированной
клетке культуры ткани, с помощью антител
диагностической
иммунной сыворотки, специфических
иммуноглобулинов или моноклональных
антител,
меченых флюорохромом, обычно флюоресцеином
(рис. 30).
Индикация
вирусов с помощью электронно-микроскопического
метода (ЭММ) применяется,
в основном, в научных исследованиях.
Материал
для ЭММ концентрируют различными
методами (ультрацентрифугирование,
хроматография
на колонках, адсорбцией с помощью
специальных сорбентов
или антител – для метода иммунной
электронной микроскопии). ЭММ
позволяет обнаружить в
ядре или цитоплазме
клеток отдельные вирионы, а также их
скопления. В практических целях ЭММ
может быть полезен для индикации и
идентификации вирусов
с типичной морфологией (оспенные
вирусы, ротавирусы, коронавирусы, ВИЧ
и т.д.).
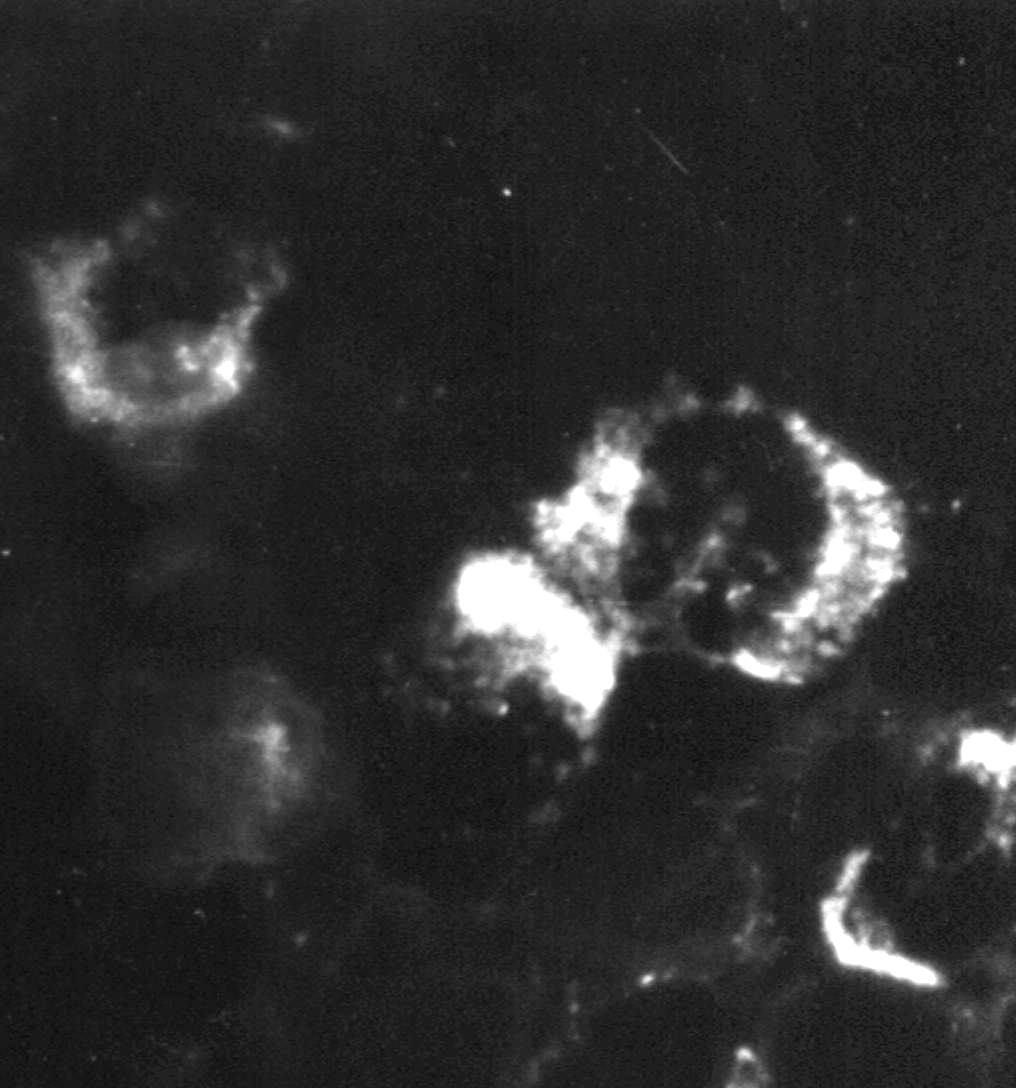
Рис.
30. Реакция иммунофлюоресценции (РИФ) –
выявление вирус-специфических антигенов.
х900
Индикация
вирусов
по
образованию бляшек —
очагов
разрушенных вирусом монослоя культуры
клеток под агаровым покрытием.
Количество бляшек отражает инфекционную
активность вируса.
Для
постановки этой пробы вирусную суспензию
в разных разведениях вносят в культуры
ткани, находящиеся в плоских сосудах,
после чего монослой клеток заливают
гелем (слой агара или бентонита с
индикатором нейтральным красным). Время
бляшкообразования для большинства
вирусов, обладающих ЦПД, варьирует от
36
до 48 ч.
Бляшки
выглядят
в виде неокрашенных светлых
пятен на розово-красном фоне окрашенного
монослоя. В бентонитовом методе монослой
клеток молочного цвета, бляшки прозрачные.
Индикация
вирусов в куриных эмбрионах. Зараженные
РКЭ инкубируют в
термостате при 35- 370
С в течение 48 -72 ч.,
после чего производят их вскрытие,
амниотическую
и аллантоисную
жидкость отсасывают шприцем, а оболочки
и эмбрион извлекают
и помещают в стерильные чашки Петри.
При
репродукции некоторых вирусов
(натуральной
оспы, осповакцины, простого герпеса) на
ХАО куриных
эмбрионах появляются характерные бляшки
— беловатые пятна диаметром 1-2
мм, количество которых соответствует
числу инфекционных частиц.
В
аллантоисной и амниотической
жидкости зараженных эмбрионов ряд
вирусов (например, ортомиксовирусы,
парамиксовирусы, аденовирусы и т.д.)
может быть выявлен с помощью реакция
гемагглютинации (РГА).
Принцип реакции состоит в способности
гемагглютининов -поверхностных
вирусных структур гликопротеидной
природы
этих вирусов
склеивать
(агглютинировать) эритроциты определенных
видов животных, птиц или человека. РГА
не относится к иммунологическим
реакциям, поскольку в ее основе отсутствует
взаимодействие АГ и AT.
РГА
ставят обычно в пробирках или в специальных
полистироловых планшетах.
Для этого готовят
двукратные разведения вирусосодержащего
материала на ФР в
объеме 0,5 мл. Во все пробирки добавляют
0,5 мл 1% взвеси эритроцитов. В контроле
к 0,5 мл ФР добавляют аналогичный объем
взвеси эритроцитов.
Пробы учитывают через 30-60 мин инкубации
при комнатной температуре, в термостате
при 370
С
или в холодильнике при 40
С.
Положительная реакция характеризуется
выпадением осадка эритроцитов в виде
«зонтика» с фестончатыми краями; при
отрицательном результате эритроциты
оседают в виде компактного осадка
(«пуговки» — рис. 31). Гемагглютинационный
титр (максимальное
разведение вирусосодержащей жидкости,
вызывающее агглютинацию
эритроцитов — одна
гемагглютинирующая единица вируса,1
ГЕ)
соответствует
концентрации вируса. Агглютинацию
эритроцитов могут вызывать также
некоторые бактерии
(стафилококки, эшерихии, сальмонеллы,
шигеллы, холерный вибрион Эль-Тор), что
необходимо учитывать при трактовке
результатов РГА при исследовании
вирус-содержащего материала,
загрязненного бактериальной микрофлорой.
Определение
титра вирусов можно проводить также на
хорионаллантоисной
оболочке.Для
этого в лунки стерильных полистироловых
пластин помещают кусочки скорлупы
11-12-дневного куриного эмбриона с
неповрежденной
ХАО, добавляют вирусосодержащую жидкость
в десятикратных
разведениях на буфере, накрывают пластины
фольгой
и инкубируют при 35-37 0
С в течение 24-72 часов. После этого скорлупу
удаляют, добавляют
0,5% взвесь куриных эритроцитов и производят
учет реакции по эффекту гемагглютинации,
который свидетельствует о репродукции
вируса.
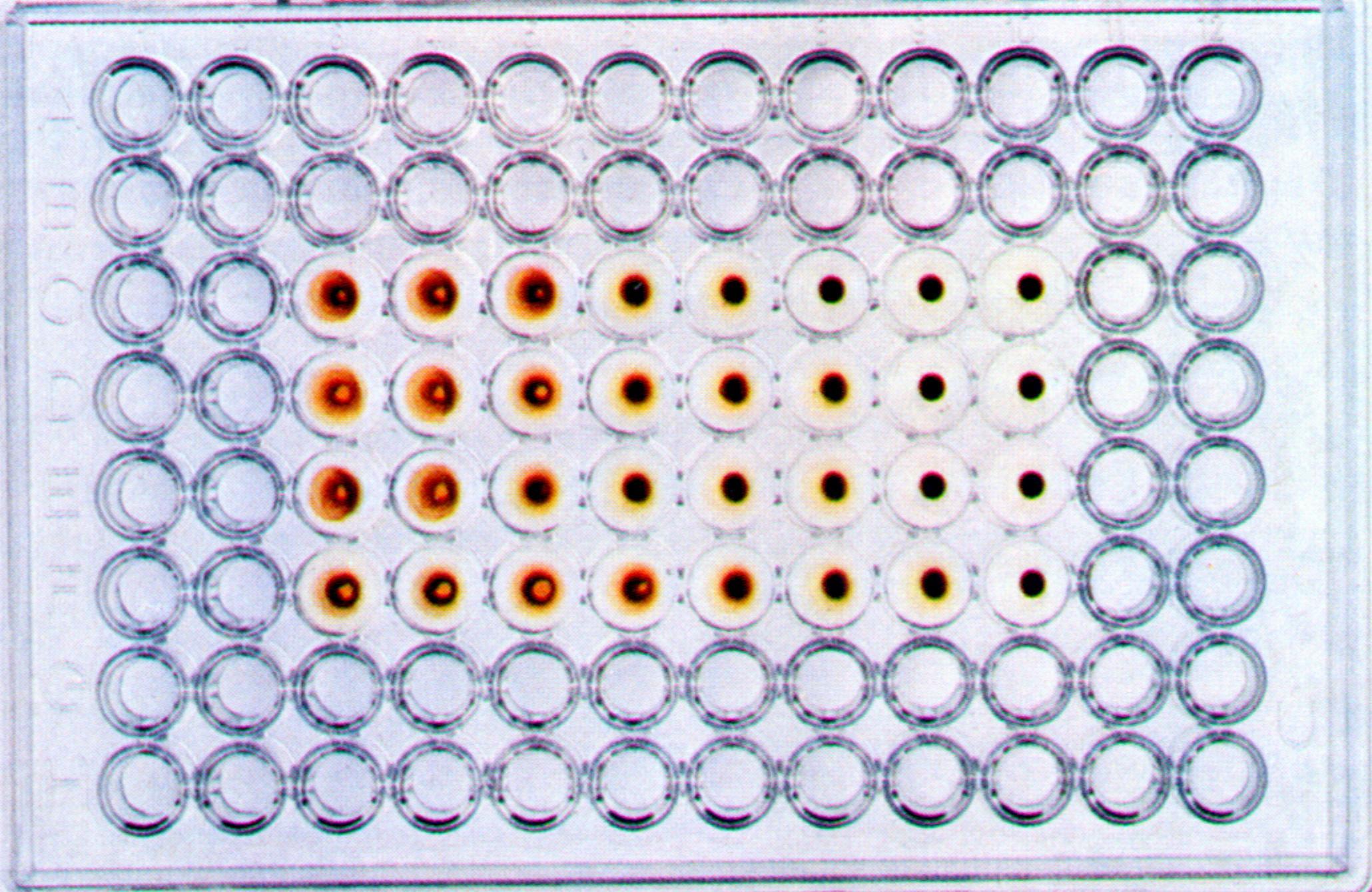
Рис. 31.
Реакция гемагглютинации для выявления
вируса гриппа в хорион-аллантоисной
жидкости куриного эмбриона.
Индикация
вирусов в организме лабораторных
животных находится
в зависимости от вируса и вида
чувствительного лабораторного животного,
будет описана в лабораторной диагностике
конкретных вирусных инфекций.
Идентификация
вирусов
Проводится с
помощью следующих методов.
Источник


