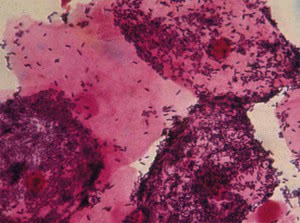
Диагностика кандидоза микологический метод
1. КАНДИДОЗЫ
1) антропоноз
2) эндогенная инфекция
3) маркер ВИЧ-инфекции
4) группа риска – недоношенные дети
5) все вышеперечисленное
Правильный ответ 5
2. ДРОЖЖЕПОДОБНЫЕ ГРИБЫ РОДА CANDIDA
1) условно-патогенные микроорганизмы
2) абсолютные патогены
3) возбудители особо опасных инфекций
4) абсолютные внутриклеточные паразиты
5) не входят в состав нормофлоры
Правильный ответ 1
3. ДРОЖЖЕПОДОБНЫЕ ГРИБЫ РОДА CANDIDA
1) архебактерии
2) прокариоты
3) эукариоты
4) вирусы
5) простейшие
Правильный ответ 3
4. ВОЗБУДИТЕЛИ КАНДИДОЗА ПОРАЖАЮТ
1) кожу
2) слизистые оболочки
3) ЖКТ
4) мочевыделительную систему
5) все вышеперечисленное
Правильный ответ 5
5. НАИБОЛЕЕ ЧАСТО ДРОЖЖЕПОДОБНЫЕ ГРИБЫ РОДА CANDIDA ВЫЗЫВАЮТ У ДЕТЕЙ ДОШКОЛЬНОГО ВОЗРАСТА
1) вульвовагинит
2) пеленочный дерматит
3) гранулематозный кандидоз
4) молочницу
5) все вышеперечисленное
Правильный ответ 4
6. ПУТИ ИНФИЦИРОВАНИЯ НОВОРОЖДЕННЫХ
1) внутриутробный
2) при прохождении через родовые пути матери
3) контактным путем (кожа соска матери)
4) алиментарным путем с введением прикорма
5) все вышеперечисленные
Правильный ответ 5
7. СПЕЦИФИЧЕСКИЕ ФАКТОРЫ ИММУНИТЕТА В ОТНОШЕНИИ CANDIDA SPP .
1) неповрежденная кожа и слизистые
2) фагоцитоз
3) лизоцим
4) комплемент
5) антитела
Правильный ответ 5
8. В ЭПИДЕМИОЛОГИИ КАНДИДОЗОВ У ПОДРОСТКОВ ВЕДУЩАЯ РОЛЬ ПРИНАДЛЕЖИТ
1) воздушно-капельному пути
2) контактному пути
3) парентеральному пути
4) эндогенному пути
5) алиментарному пути
Правильный ответ 4
9. ДЛЯ ПЕРВИЧНОГО ПОСЕВА КЛИНИЧЕСКОГО МАТЕРИАЛА ОПТИМАЛЬНО ИСПОЛЬЗОВАТЬ ПИТАТЕЛЬНЫЕ СРЕДЫ
1) Сабуро, сусло-агар
2) кровяной и сывороточный агары
3) Эндо, Плоскирева
4) МПА, сахарный МПБ
5) хромогенные (Candi-select и др.)
Правильный ответ 5
10. КОЛИЧЕСТВО CANDIDA SPP . ПРИ ИССЛЕДОВАНИИ МАТЕРИАЛА ИЗ НЕСТЕРИЛЬНОГО ЛОКУСА, СВИДЕТЕЛЬСТВУЮЩЕЕ ОБ ИХ ЭТИОЛОГИЧЕСКОЙ РОЛИ
1) 10
2) 102
3) 103
4) 104-105
5) не менее 106
Правильный ответ 4
11. ЧИСЛО ПОСЕВОВ КРОВИ В ДЕНЬ ПРИ ДИАГНОСТИКЕ КАНДИДЕМИИ
1) однократно
2) один — два
3) один — три
4) один — четыре
5) три (от двух до четырех)
Правильный ответ 5
12. ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ПРИ МИКРОСКОПИЧЕСКОМ МЕТОДЕ ДИАГНОСТИКИ КАНДИДОЗА ИМЕЕТ ВЫЯВЛЕНИЕ
1) биопленок
2) псевдомицелия, бластоспор
3) бластоспор
4) хламидоспор
5) галактоманнана
Правильный ответ 2
13. ПОСТИНФЕКЦИОННЫЙ ИММУНИТЕТ ПРИ КАНДИДОЗАХ
1) антитоксический
2) клеточно-гуморальный
3) напряженный
4) нестерильный
5) естественный
Правильный ответ 2
14. ОБНАРУЖЕНИЕ ПСЕВДОМИЦЕЛИЯ В МАЗКАХ ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА СВИДЕТЕЛЬСТВУЕТ О
1) инвазивном процессе
2) реконвалесценции
3) здоровом носительстве
4) кандидемии
5) токсинемии
Правильный ответ 1
15. В МАЗКАХ ИЗ ПАТОЛОГИЧЕСКОГО МАТЕРИАЛА, ОКРАШЕННЫХ ПО ГРАМУ, C . ALBICANS
1) грамотрицательны
2) розовые
3) грамвариабельны
4) грамположительны
5) фиолетовые
Правильный ответ 5
16. ДЛЯ C . ALBICANS ХАРАКТЕРНО
1) образование истинного мицелия
2) наличие хламидоспор
3) наличие бластоспор
4) наличие дифференцированного ядра
5) образование ростовых трубок
Правильный ответ 5
17. ОСНОВНОЙ МЕТОД МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ КАНДИДОЗОВ
1) микроскопический
2) молекулярно-генетический
3) аллергологический
4) микологический
5) серологический
Правильный ответ 4
18. ФАКТОРЫ РИСКА РАЗВИТИЯ ИНВАЗИВНОГО КАНДИДОЗА
1) колонизация нескольких участков тела
2) сосудистый катетер
3) антибиотики широкого спектра действия
4) сахарный диабет
5) все вышеперечисленное
Правильный ответ 5
19. СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА КАНДИДОЗОВ У ДЕТЕЙ
1) своевременная санация больных кандидозом матерей
2) лечение иммунодефицитов
3) рациональная антибиотикотерапия
4) контроль санитарно-гигиенического режима в роддомах
5) не разработана
Правильный ответ 5
20. ПРЕПАРАТ ВЫБОРА ПРИ ЛЕЧЕНИИ ИНФЕКЦИЙ, ВЫЗВАННЫХ C . KRUSEI , C . GLABRATA
1) нистатин
2) амфотерицин В
3) клотримазол
4) каспофунгин
5) флуконазол
Правильный ответ 4
21. КАНДИДОЗ
1) зооноз
2) антропоноз
3) природно-очаговая инфекция
4) трансмиссивная инфекция
5) сапроноз
Правильный ответ 2
22. ОСНОВНОЙ ВОЗБУДИТЕЛЬ КАНДИДОЗОВ
1) Candida parapsilosis
2) C . tropicalis
3) C . guillermondii
4) C . krusei
5) C . albicans
Правильный ответ 5
23. ПАТОГЕНЕТИЧЕСКАЯ ФАЗА ДРОЖЖЕПОДОБНЫХ ГРИБОВ РОДА CANDIDA ХАРАКТЕРИЗУЕТСЯ ОБРАЗОВАНИЕМ
1) сферических или овальных клеток
2) истинного мицелия
3) аскоспор
4) псевдомицелия
5) хламидоспор
Правильный ответ 4
24. СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕПОДОБНЫХ ГРИБОВ РОДА CANDIDA
1) КА
2) МПА
3) Сабуро
4) Эндо
5) МПБ
Правильный ответ 3
25. ИСТОЧНИК ИНФЕКЦИИ ПРИ КАНДИДОЗАХ
1) больные люди
2) здоровые носители
3) больные животные
4) медицинский инструментарий
5) пищевые продукты
Правильный ответ 1
26. ОСНОВНАЯ КЛИНИЧЕСКАЯ ФОРМА КАНДИДОЗА КОЖИ У ГРУДНЫХ ДЕТЕЙ
1) паронихии и онихии
2) молочница
3) вульвовагинит
4) пеленочный дерматит
5) кандидемия
Правильный ответ 4
27. ОСНОВНАЯ ОСОБЕННОСТЬ ПАТОГЕНЕЗА КАНДИДОЗОВ
1) кандидемия
2) токсинемия
3) сенсибилизация организма
4) только острое течение
5) дифтеритическое воспаление
Правильный ответ 3
28. ФАКТОРЫ ПАТОГЕННОСТИ ДРОЖЖЕПОДОБНЫХ ГРИБОВ РОДА CANDIDA
1) фосфолипазы
2) олигосахариды клеточной стенки
3) кислые протеазы
4) адгезины
5) все вышеперечисленные
Правильный ответ 5
29. ИССЛЕДУЕМЫЙ МАТЕРИАЛ ДЛЯ МИКОЛОГИЧЕСКОЙ ДИАГНОСТИКИ КАНДИДОЗНОЙ УРОИНФЕКЦИИ
1) СМЖ
2) испражнения
3) смыв со слизистой оболочки
4) кровь
5) моча
Правильный ответ 5
30. МЕТОД МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ КАНДИДЕМИИ
1) микроскопический
2) биологический
3) микологический
4) серологический
5) аллергологический
Правильный ответ 3
31. ФАКТОРЫ РИСКА РАЗВИТИЯ КАНДИДОЗА У ДЕТЕЙ
1) антибиотикотерапия
2) оперативные вмешательства
3) гормонотерапия (кортикостероидами)
4) недоношенность
5) все вышеперечисленное
Правильный ответ 5
32. ОСНОВНАЯ МИШЕНЬ ДЕЙСТВИЯ АНТИМИКОТИКОВ
1) рибосомальные белки
2) компоненты мембраны (эргостерол)
3) нуклеиновые кислоты
4) компоненты клеточной стенки
5) рибосомы 80S
Правильный ответ 2
33. КЛЕТОЧНЫЙ ИММУНИТЕТ ПРИ КАНДИДОЗАХ ХАРАКТЕРИЗУЕТСЯ
1) развитием ГЧЗТ
2) прямым фунгицидным действием Т-клеток
3) активацией фагоцитоза
4) активацией СД 4+ клеток
5) все вышеперечисленное
Правильный ответ 5
34. ДЛЯ СЕРОДИАГНОСТИКИ КАНДИДОЗА ИСПОЛЬЗУЮТ
1) КАП
2) ПЦР
3) определение галактоманнана
4) определение псевдомицелия
5) ИФА
Правильный ответ 5
35. СЕРОДИАГНОСТИКА КАНДИДОЗА ИСПОЛЬЗУЕТСЯ, В ОСНОВНОМ, ДЛЯ ВЫЯВЛЕНИЯ
1) текущего заболевания
2) внутрибольничного заражения
3) ретроспективной диагностики
4) кандидемии
5) внутриутробного инфицирования
Правильный ответ 3
36. ДЛЯ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ CANDIDA SPP . К АНТИМИКОТИКАМ НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЮТ МЕТОД
1) Е-тестов
2) дисков
3) серийных разведений
4) абсолютных концентраций
5) тест-систему «Fungitest»
Правильный ответ 5
37. ПРИЧИНА НЕЭФФЕКТИВНОСТИ ПРОТИВОКАНДИДОЗНОЙ ТЕРАПИИ
1) образование хламидоспор
2) способность к филаментации
3) образование бластоспор
4) L-трансформация
5) образование биопленок
Правильный ответ 5
38. СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА КАНДИДОЗОВ У ДЕТЕЙ
1) рациональная антибиотикотерапия
2) иммунокоррекция
3) обследование беременных
4) соблюдение санитарно-гигиеничес-кого режима в роддоме
5) не разработана
Правильный ответ 5
39. ГУМОРАЛЬНЫЙ ОТВЕТ ПРИ КАНДИДОЗАХ ХАРАКТЕРИЗУЕТСЯ ОБРАЗОВАНИЕМ
1) ГЧЗТ, IgM, IgG, IgA
2) только низкоавидных IgG
3) только высокоавидных IgG
4) только IgM, IgG
5) IgM, IgG, IgA
Правильный ответ 5
40. ДЛЯ СПЕЦИФИЧЕСКОЙ ТЕРАПИИ ХРОНИЧЕСКИХ ФОРМ КАНДИДОЗОВ ИСПОЛЬЗУЮТ
1) инактивированную вакцину
2) каспофунгин
3) иммуноглобулины
4) бактериофаги
5) не разработана
Правильный ответ 1
Источник
… грибы рода Candida размножаются на любом биологическом субстрате.
В связи с тем, что для заболевания кандидозом характерен полиморфизм клинических проявлений лабораторному исследованию подлежит разнообразный патологический материала. В зависимости от характера и локализации поражения, для лабораторного анализа берут:
• мокроту;
• соскобы с кожи или слизистых оболочек;
• ногтевые чешуйки;
• кровь, ликвор, мочу, желчь, фекалии;
• пунктаты из закрытых полостей, отделяемое свищей;
• биопсированный и секционный материал.
Вначале производят исследование нативного материала (за исключением крови); при этом ликвор, мочу и желчь подвергают (!) предварительному центрифугированию (1500 — 2000 об/мин, 10 — 15 мин). Препараты готовят в 10 — 20% растворе щелочи при слабом нагревании.
Обнаружение нитчатой фазы возбудителя (мицелия или псевдомицелия) является важным свидетельством наличия кандидоза. Количество дрожжевых клеток в каждом поле зрения служит ориентиром при подготовке серийных разведений для количественного посева на плотные питательные среды: единичные клетки в поле зрения при большом увеличении микроскопа (х400) свидетельствуют об их содержании порядка десятков тысяч в 1 мл исследуемого материала.
Разведения патологического материала, содержащего нормальную микрофлору (мокрота, фекалии, моча, желчь и т.д.), готовят в жидкой питательной среде (обычно жидкое сусло или жидкая среда Сабуро) и затем высевают определенное количество материала (0,1 — 0,2 мл) на аналогичные плотные среды. Для подавления роста контаминирующих бактерий в среды добавляют антибактериальные антибиотики (чаще всего применяют пенициллин и стрептомицин: по 50 — 100 ед/мл среды или 0,05% хлорамфеникола).
Если вместо соскобов использованы смывы, то тампоны предварительно встряхивают в течение нескольких минут в 5 — 7 мл жидкой питательной среды, а затем производят посев на плотные среды определенного объема соответствующего разведения исходной взвеси. Соскобы с кожи и ногтевых пластинок помещают на скошенные питательные среды. Посев крови и ликвора производят в 10-кратный объем жидкой среды Сабуро или МПБ с 2% глюкозы без добавления антибиотиков, так как кандидозная фунгемия иногда сочетается с бактериальным сепсисом. Наиболее высокую эффективность выделения грибов из крови удалось обеспечить при использовании комбинированной сердечно-мозговой среды. Посев крови делают 3-4-кратно, осуществляя забор из разных вен с интервалом в несколько дней при (1) отсутствии парентерального питания или (2) капельного введения лекарственных веществ. При наличии у больного фунгемии рост грибов появляется через 24-48 ч, максимальная инкубация осуществляется до 30 суток при периодических пересевах на плотную питательную среду.
Биопсированный и секционный материал используют для приготовления гистологических препаратов (окраска PAS-методом), а остатки материала высевают (методом отпечатков или после предварительного измельчения) на плотные и в жидкие питательные среды. Инкубацию предпочтительнее проводить при 25 — 30оС, хотя патогенные для человека виды грибов хорошо растут и при 37оС. Достаточных размеров колонии формируются через 48 ч культивирования, хотя точечный рост можно обнаружить уже на следующий день после первичного посева. При отсутствии роста на агаровых средах делают высев с жидких питательных сред на сектора для получения изолированных колоний.
При исследовании мочи наряду с культуральным методом рекомендуется дополнительное исследование, имеющее целью (!) выявление иммуноглобулинов человека на поверхности бластоспор. Для этого около 5 мл второй порции мочи центрифугируют в течение 5-10 мин при 1500 об/мин и из осадка готовят (1) нативные препараты и мазки, окрашенные по Граму, а также (2) препараты для иммунолюминесцентного исследования при котором фиксацию осуществляют метанолом, а после высушивания мазка наносят антисыворотку против глобулинов человека, меченную изотиоцианатом флюоресцеина.
В осадке мочи больных мочекаменной болезнью нередко (около 7% проб) присутствуют клетки золотистого стафилококка (В.Г. Кубась и соавт.), которые за счет наличия у них белка А неспецифически связывают Fc-фрагменты IgG, что может привести к получению ложноположительных результатов реакции иммунолюминесценции. При выявлении грамположительных кокков для блокировки белка А рекомендовано (В.Г. Кубась и соавт.) к осадку мочи добавлять равный объем кроличьего глобулина с концентрацией белка 1,0 мг/мл. После (1) инкубации смеси при 37оС в течение 30 мин и (2) 3-кратного промывания осадка фосфатным буферным раствором (3) готовят мазки и (4) фиксируют их метанолом. Предварительная обработка кроличьим глобулином взвесей золотистых стафилококков (100-500 млн/мл) подавляла их неспецифическую флюоресценцию.
Выявление светящихся дрожжевых клеток при параллельном обнаружении дрожжей в нативном и окрашенном по Граму препаратах свидетельствует о том, что они несут на своей поверхности специфические глобулины, то есть о наличии у пациента тканевых поражений. Положительный антиглобулиновый тест свидетельствует о кандидозном поражении мочевыводящих путей. Контролем для исключения аутофлюоресценции дрожжевых клеток является исследование неокрашенного препарата.
(!) Видовое определение выделенных культур является важным критерием диагностики и имеет комплексный характер, включающий (1) изучение внешнего вида колонии, (2) ферментативной активности и (3) ассимиляционной способности штамма, (4) типа филаментации, а также (5) характера роста в жидкой питательной среде (наличие поверхностной пленки, поднимающееся по стенке пробирки над поверхностью среды кольцо и т.д.). Большинство патогенных для человека видов грибов рода Candida может быть идентифицировано без постановки ассимиляционного теста.
Из-за резкого преобладания C. albicans у больных и миконосителей, у выросшей культуры прежде всего выявляют наличие характерного морфологического признака этого вида — хламидоспоры. С этой целью производят прерывистый штриховой посев на рисовый агар, часть посева покрывают фламбированным покровным стеклом. Посевы инкубируют при 37оС или при 22оС. Подавляющее большинство штаммов C. albicans образуют хламидоспоры через 12-24 ч, реже — через 48 ч. Выявление хламидоспор позволяет идентифицировать культуру как C. albicans и не проводить дальнейших исследований. Культуры, у которых хламидоспоры выявить не удалось, исследуют по комплексу признаков.
Ферментативную активность определяют на обычных средах «пестрого ряда» или в дрожжевом аутолизате, в которых конценирация углеводов должна составлять 2%. Инкубацию проводят при 25-28оС. Некоторые штаммы могут вызывать ферментацию в поздние сроки (10-20 дней), поэтому для ускорения процесса рекомендуют использовать агаризованные Среды (0,1-0,15% агар-агара); при этом срок наблюдения сокращается до 2 дней.
При постановке ассимиляционного теста в стерильную чашку Петри вносят 1-2 мл взвеси культуры, которую заливают 18-20 мл базовой среды с добавлением дрожжевого аутолизата, охлажденной до 43-45°. После застывания агара его подсушивают и на поверхность наносят стерильные диски фильтровальной бумаги, пропитанной 20% или насыщенным раствором изучаемого источника питания. Можно также на поверхность агара наносить небольшие количества нерастворенного источника питания. Чашки инкубируют в перевернутом виде при 25-28оС; в положительных случаях в течение 2-4 дней вокруг источника питания обнаруживается рост культуры гриба.
Для выявления типов роста посев осуществляется на картофельный агар с 1% глюкозы методом «врезания»: микологическую лопатку с биомассой культуры погружают на 1/3 толщины агара, причем посев делают в виде двух сходящихся, но не пересекающихся лучей. Чашки инкубируют в течение суток при 37оС, а затем при 25оС. Нитчатая форма образуется в толще агара по периферии посева в течение 3-7 дней. При задержке филаментации культуру засевают на среду Городковой, посевы инкубируют при 22оС в течение 10-15 дней, периодически исследуя для выявления аскоспор. Также наряду с микроскопическим исследованием нативных препаратов, мазки окрашивают по Цилю-Нильсену; при этом кислотоустойчивые споры воспринимают рубиново-красную окраску. Эффективное окрашивание спор истинных дрожжей достигается при использовании 2% водного раствора фуксина.
В последнее десятилетие разработан ряд автоматизированных систем для видовой идентификации грибов рода Candida, в основу которых положено определение ассимиляционной способности изучаемых культур. Каждая лунка содержит определенный источник питания, посевы инкубируются при 30оС в течение 24 ч. Помутнение среды свидетельствует об ассимиляции данного источника питания, регистрация результатов производится фотометрически. При помощи компьютера по нумерационно-кодовому принципу осуществляют видовое определение штамма.
Серологическая диагностика. Высокую диагностическую значимость имеет реакция непрямой иммунолюминесценции. У большинства здоровых лиц ее интенсивность составляет 1:10 — 1:20, диагностическим считается титр 1 и более. Для реакции агглютинации частиц латекса, сенсибилизированных соматическими антигенами, диагностическим считают титр 1:8; у больных с выраженной иммуносупрессией диагностическое значение имеет 4-кратное увеличение титра в процессе заболевания. Для поиска антигенов гриба используют частицы латекса, сенсибилизированные антителами, но во избежание ложноположительных результатов, в сыворотке должен отсутствовать ревматоидный фактор.
При использовании встречного иммуноэлектрофореза выявление 2 и более дуг преципитации имеет диагностическую ценность. У здоровых лиц, а также у больных поверхностным кандидозом дуги преципитации, как правило, отсутствуют. При перекрестном иммуноэлектрофорезе у больных висцеральным кандидозом выявляется в среднем 10 дуг преципитации (пределы колебаний — 5-20), при кандидозном эндокардите — около 8 (1-11), а в контрольной группе — 2 (0-5). Специфичность метода увеличивается при использовании промежуточного геля с конкавалином А, который связывает маннан, содержащийся в виде примеси в препаратах соматических антигенов.
Большую ценность, чем титрование антител, имеет определение в сыворотке циркулирующих антигенов гриба, особенно цитоплазматических. Определение антигенов осложняется формированием в сыворотке иммунных комплексов. Полисахаридные антигены высвобождаются из этих комплексов кипячением, для белковых антигенов методы выделения не разработаны. При диссеминированном кандидозе маннан выявляют у 50-70% больных при его отсутствии у здоровых лиц, что придает находке диагностическую значимость. Методом газо-жидкостной хроматографии в сыворотке определяют метаболиты гриба — маннозу и арабинитол. Определение сывороточного содержания арабинитола основывается на способности некоторых видов (C. albicans, C. tropicalis, C. pseudotropicalis, C. parapsilosis) синтезировать это вещество. При почечной недостаточности рекомендуется одновременное определение концентрации арабинитола и креатинина, так как скорость выделения этих веществ одинакова.
Диагностика системного кандидоза. Своевременный диагноз системного кандидоза представляет значительные трудности, поскольку клиническая симптоматика неспецифична. В диагностике кандидоза основная роль принадлежит лабораторным методам исследования: микроскопическим, культуральным, газохроматофическим и молекулярным.
Выявление кандидемии считается наиболее значимым диагностическим маркером гематогенного кандидоза и служит абсолютным показанием к проведению противогрибковой терапии. Следует иметь в виду, что системный кандидоз может не сопровождаться кандидемией. Наиболее важным признаком диссеминированного кандидоза является грибковый эндофтальмит (экссудативные изменения желто-белого цвета сосудистой оболочки глаза). Поэтому офтальмологическое обследование считается весьма значимым в комплексе диагностики и мониторинга больных, имеющих факторы риска диссеминированной кандидозной инфекции. Однако кандидозный эндофтальмит не является начальным признаком генерализации грибковой инфекции, даже у больных с кандидемией поражение сетчатой оболочки выявляют лишь в 9-15% случаев. Другие проявления диссеминированного кандидоза (в частности, поражения кожи и артрит) отмечаются крайне редко у больных в ОИТ. После операций, не затрагивающих почки, мочевой пузырь, а также в тех случаях, когда не было длительной катетеризации мочевого пузыря, кандидурия с выделением большого числа КОЕ является весьма подозрительным симптомом гематогенного поражения почек.
Серологические методы включают определение антител к Candida spp. с помощью различных методов: (1) агглютинации, (2) иммуноэлектрофореза и (3) иммунодилюции. К сожалению, интерпретация получаемых данных часто затруднительна, поскольку антитела обнаруживаются и у здоровых людей, и в случаях обычной колонизации. Более того, эти методы дают отрицательный результат при грибковой инфекции у больных с иммунодефицитными состояниями и в начальной стадии системного кандидоза. Большей информативностью обладают серологические методы определения антигенов Candida spp., однако они также обладают лишь умеренной чувствительностью в случаях системного кандидоза.
Перспективным методом диагностики является хроматографическое определение метаболитов грибов — D-арабинитола в различных биологических жидкостях и тканях инфицированных больных. Большинство патогенных Candida spp. (кроме С. crusei и C. glabrata) продуцируют значительное количество D-изомера арабинитола, и в сыворотке больных при инвазивном кандидозе определяется его повышенное содержание, а также повышение отношения D-арабинитол/креатинин. В проспективных клинических исследованиях подтверждена значимость серийных определений D-арабинитола для диагностики кандидоза у онкологических больных с нейтропенией. Однако инвазивный кандидоз во многих случаях протекает без кандидемии, что не может не отражаться на содержании D-арабинитола в крови и снижает диагностическую ценность метода.
Весьма информативным является метод молекулярной лабораторной диагностики — полимеразная цепная реакция (ПЦР), позволяющая определить специфические области ДНК C. albicans, а также других грибов, в частности Аspergillus spp. Чувствительность ПЦР достигает 100%, а специфичность — 98%. По данным H.Einsele и соавт. (1997), положительная ПЦР позволяет в среднем на 4 дня раньше, чем при обычном обследовании, установить диагноз диссеминированного кандидоза или легочного аспергиллеза. Высокая чувствительность метода позволила K.Ikegami и соавт. (1999) определить наличие ДНК грибов в крови у более 50% больных в критическом состоянии, у которых не было фунгемии, а у многих также и признаков системной воспалительной реакции. Однако, по мнению M.Ruhnke (1999), подтверждение диагностической роли молекулярных методов исследования нуждается в дальнейших доказательных клинических исследованиях.
Источник