Клиническая картина диагностика и лечение язвенного колита у детей

Неспецифический язвенный колит — заболевание, спровоцированное воспалительными процессами в толстом кишечнике. Чаще симптомы патологии диагностируют у пациентов в возрасте 15 — 30 лет и людей старше 60. Несмотря на такие возрастные рамки, диагноз «неспецифический язвенный колит» нередко ставят в детском возрасте. В статье рассматриваем специфику протекания НЯК у детей, методы лечения и прогнозируемые результаты терапии.
Содержание:
- Группа риска
- Почему дети заболевают НЯК
- Можно ли вылечить неспецифический язвенный колит
- Что делать, если ребенку поставили диагноз НЯК
- Язвенный колит и лечение препаратами
- На что жалуется ребенок
- Другие особенности симптоматики
- Классификация заболевания
- Диагностические мероприятия при НЯК
- Прогнозы
Группа риска
Согласно данным проведенных исследований, неспецифический язвенный колит чаще диагностируют у мужчин 25-29 лет. Женщины заболевают в период 15-19 лет. Люди в возрасте 55-65 лет находятся во второй уязвимой возрастной группе.
Этиология заболевания до конца не изучена, но считается, что воспалительные процессы могут спровоцировать такие факторы:
- Инфекции (бактериальные и вирусные патогены);
- Длительный прием оральных контрацептивов;
- Продолжительная гормональная терапия;
- Увлечение некоторыми видами диет;
- Курение.
Прослеживается взаимосвязь между повышенными рисками развития НЯК на фоне длительной терапии противовоспалительными препаратами нестероидного типа. Неспецифический язвенный колит у ребенка или взрослого появляется из-за пагубного действия на ЖКТ медикаментов, вызывающих в качестве побочных явлений пищевые аллергии.
Спровоцировать НЯК могут: перенесенный в детском возрасте паротит, расовая предрасположенность (доказано, что заболеванию подвержены люди белой расы, особенно еврейской национальности), отказ от курения (при условии, что у курильщика большой стаж).
Почему дети заболевают НЯК
НЯК — патология, по принципу развития и клинической картине схожая с болезнью Крона. От других ВЗК ее отличает чередование стадий ремиссии и обострения.
Достоверно неизвестно, почему дети разного возраста страдают от патологии КТ, но негласно гастроэнтерологи склоняются к генетической предрасположенности, как к основному фактору риска.
Немаловажную роль играют внешние факторы. Колит связывают с агентами извне, которые, попадая в ЖКТ, провоцируют воспаления в толстой кишке.
Распространенность НЯК — в пределах 41-116 случаев на 100 тыс. человек. Большой показатель летальных исходов отмечается, если симптомы неспецифического язвенного колита у детей появляются в выраженной форме, а заболевание при этом протекает молниеносно. При таких сценариях в кишечнике в течение года образуются злокачественные новообразования.
Можно ли вылечить неспецифический язвенный колит
Лечение неспецифического язвенного колита производится с целью устранить симптомы, беспокоящие ребенка, нормализовать естественные процессы в ЖКТ и продлить состояние ремиссии. НЯК считается хронической патологией кишечника, поэтому ни один врач не может гарантировать абсолютный успех терапевтического эффекта или спрогнозировать следующий рецидив.
Для колита характерно циклическое течение: периоды обострения патологии чередуются со спокойной фазой, которая может длиться месяцами.
Помимо лечения язвенного колита препаратами, важную роль играет строгий рацион питания. В остром периоде при НЯК рекомендована категоричная диета, в моменты ремиссии — более мягкая.
Что делать, если ребенку поставили диагноз НЯК
В первую очередь, родители детей с диагнозом «НЯК» должны осознать всю серьезность ситуации. Доскональное соблюдение рекомендаций лечащего врача и следование принципам диетического питания помогут устранить болезненные симптомы у ребенка и поспособствуют стабилизации состояния.
Питание при колите у детей предусматривает контроль баланса минералов и витаминов в продуктах из ежедневного рациона. Важно: превышение допустимых норм потребления жирной пищи и углеводосодержащих продуктов во время ремиссии может спровоцировать новый рецидив.
Для корректировки рациона ребенка родители могут обратиться к диетологу, который составит правильный план питания, подходящий для разных периодов болезни.
Язвенный колит и лечение препаратами
Основная задача в ходе терапевтического процесса — частично или полностью купировать воспаление и ослабить влияние на кишечник болезнетворных микроорганизмов. Для этого назначаются противовоспалительные лекарственные средства. Сложность процесса протекания неспецифического язвенного колита у детей зависит от симптомов и эффективности лечения.
Медикаментозная корректировка состояния пациента включает прием таких лекарств:
- Глюкокортикоидов (особенно эффективны при левосторонних формах колита);
- Антибиотиков (рекомендованы в моменты рецидива, в том числе при повышенных показателях температуры тела).
При отсутствии ожидаемых результатов в рамках лечения, а также в экстренных случаях детям с НЯК рекомендована операция. Большинство пациентов не нуждаются в радикальном вмешательстве хирургов, но, согласно статистике, примерно в 20-40 процентах случаев, по мере усугубления патогенных процессов, требуется удаление части кишки.
На что жалуется ребенок
Боль в области живота — характерный признак НЯК. Ребенок, помимо болевых ощущений, теряет аппетит и может жаловаться на чувство слабости. При дефиците питательных веществ в организме могут появиться другие внекишечные признаки, такие как головокружение, головная боль, небольшая температура.
У каждого третьего пациента с колитом выраженные воспалительные процессы приводят к перфорации. На фоне неправильной работы кишечника может появляться сепсис.
При отсутствии медикаментозного лечения и несоблюдении диеты не исключаются профузные кишечные кровотечения, трещины, свищи и другие осложнения, включая летальные исходы. Риски развития рака кишечника на фоне НЯК возрастают с каждым десятилетием жизни с соответствующим диагнозом в анамнезе.
Другие особенности симптоматики
В острой фазе неспецифического язвенного колита у ребенка нарушается стул. Во время испражнений фекалии могут содержать кровь.
Длительная диарея приводит к нарушению обмена веществ и вытекающей потере веса. У ребенка снижается аппетит, он отказывается от еды.
Выделяют ряд внекишечных симптомов, связанных с осложнениями НЯК:
- Дисфункция сердечной системы;
- Сосудистые поражения (тромбоз, тромбофлебит);
- Нарушения функций почек и печени.
Продолжительные воспалительные процессы в кишечнике у детей, оставленные без внимания взрослыми, приводят к сбоям в работе систем и органов всего организма, поэтому без квалифицированной медицинской помощи могут послужить причиной инвалидности.
Классификация заболевания
По степени распространенности поражения НЯК выделяют: дистальный, левосторонний, тотальный и субтотальный колит. Для оценки тяжести заболевания используется классификация по Трулав и Виттс:
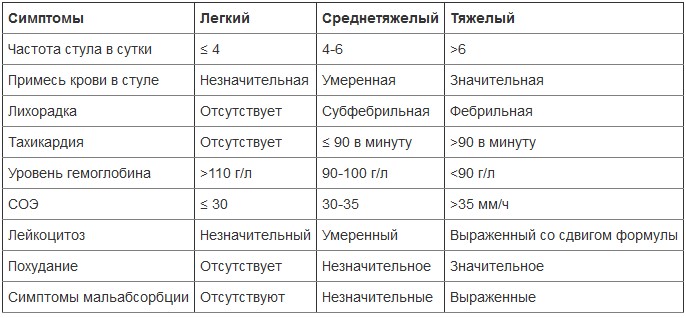
Классификация НЯК по характеру течения (виды):
- Рецидивирующий (чередование фаз ремиссии и обострения);
- Непрерывный (обострения в течение года происходят от 2 раз и чаще);
- Фульминантный (тяжелое течение и последующее развитие осложнений).
В зависимости от особенностей протекания патологии, помимо описанных клинических признаков воспаления, могут диагностироваться слизистые выделения из прямой кишки, вздутие живота, тенезмы, отеки ног, кожные высыпания, запоры и гематохезия.
Диагностические мероприятия при НЯК
При подозрениях на аутоиммунные заболевания проводятся лабораторные тесты. Анализы крови при НЯК показывают повышенное содержание лейкоцитов, а также заниженный уровень эритроцитов (типичный признак анемии из-за кишечных кровопотерь).
Образцы стула берутся с целью установить состав кала (вычисляется присутствие кровяных прожилок, слизи, а также устанавливаются потенциальные провокаторы состояния — паразиты и бактерии).
К дополнительным методам относят эндоскопию, колоноскопию и рентген с барием. При необходимости берется биопсия для дальнейшего исследования материала.
Прогнозы
Чтобы улучшить общее состояние, родителям важно учитывать социальные и эмоциональные изменения в жизни ребенка. Позитивные эмоции и поддержка близких оказывают не меньший положительный эффект, чем терапевтические методики.
Молниеносное (особо опасное развитие НЯК) происходит не более, чем в 10 процентах случаев. Более того, 10 процентов больных НЯК выздоравливают после одиночного приступа (однако вероятность рецидива в будущем сохраняется).
При поражениях больших областей толстого кишечника, по мере окончания 10-летнего периода с момента постановки диагноза, опасность развития рака увеличивается на 0,5-1 процент в год. Наибольшие риски онкологии — при тотальных случаях колита. Наиболее благоприятный прогноз делается пациентам с локальным язвенным проктитом.
Подписывайтесь на нас в социальных сетях
![]()
![]()
![]()
Поделиться ссылкой:
Источник
1. Benchimol E. I., Fortinsky K. J., Gozdyra P. et al. Epidemiology of pediatric inflammatory bowel disease: a systematic review of international trends. Inflamm. Bowel. Dis. 2011; 17: 423–439.
2. Henderson P., Hansen R., Cameron F. L. et al. Rising incidence of pediatric inflammatory bowel disease in Scotland. Inflamm. Bowel. Dis. 2012; 18: 999–1005.
3. Heyman M. B., Kirschner B. S., Gold B. D. et al. Children with earlyonset inflammatory bowel disease (IBD): analysis of a pediatric IBD consortium registry. J. Pediatr. 2005; 146: 35–40.
4. Van Limbergen J., Russell R. K., Drummond H. E. et al. Definition of phenotypic characteristics of childhood-onset inflammatory bowel disease. Gastroenterology. 2008; 135: 1114–1122.
5. Gower-Rousseau C., Dauchet L., Vernier-Massouille G. et al. The natural history of pediatric ulcerative colitis: a population-based cohort study. Am. J. Gastroenterol. 2009; 104: 2080–2088.
6. Travis S. P. L., Stange E. F., Leґmann M. et al. European evidencebased consensus on the management of ulcerative colitis: current management. J. Crohn Colitis. 2008; 2: 24–62.
7. Turner D., Travis S. P., Griffiths A. M. et al. Consensus for managing acute severe ulcerative colitis in children: a systematic review and joint statement from ECCO, ESPGHAN, and the Porto IBDWorking Group of ESPGHAN. Am. J. Gastroenterol. 2011; 106: 574–588.
8. Glickman J. N., Bousvaros A., Farraye F. A. et al. Pediatric patients with untreated ulcerative colitis may present initially with unusual morphologic findings. Am. J. Surg. Pathol. 2004; 28: 190–197.
9. Levine A., de Bie C. L., Turner D. et al. Atypical disease phenotypes in paediatric ulcerative colitis: 5-year analyses of the EUROKIDS registry. Inflamm. Bowel. Dis. 2012 [Epub ahead of print].
10. Robert M. E., Tang L., Hao L. M. et al. Patterns of inflammation in mucosal biopsies of ulcerative colitis: perceived differences in pediatric populations are limited to children younger than 10 years. Am. J. Surg. Pathol. 2004; 28: 183–189.
11. Haskell H., Andrews C. W., Jr., Reddy S. I. et al. Pathologic features and clinical significance of «backwash» ileitis in ulcerative colitis. Am. J. Surg. Pathol. 2005; 29: 1472–1481.
12. de Bie C. I., Buderus S., Sandhu B. K. et al. Diagnostic workup of paediatric patients with inflammatory bowel disease in Europe: results of a 5-year audit of the EUROKIDS registry. J. Pediatr. Gastroenterol. Nutr. 2012; 54: 374–380.
13. Koletzko S., Niggemann B., Arato A. et al. Diagnostic approach and management of cow’s milk protein allergy in infants and children: a practical guideline of the GI-committee of ESPGHAN. J Pediatr Gastroenterol Nutr. 2012; 55: 221–229.
14. Glocker E. O., Frede N., Perro M. et al. Infant colitis — it’s in the genes. Lancet. 2010; 376: 1272. 15. Glocker E. O., Kotlarz D., Boztug K. et al. Inflammatory bowel disease and mutations affecting the interleukin-10 receptor. N. Engl. J. Med. 2009; 361: 2033–2045.
15. Begue B., Verdier J., Rieux-Laucat F. et al. Defective IL10 signaling defining a subgroup of patients with inflammatory bowel disease. Am. J. Gastroenterol. 2011; 106: 1544–1555.
16. Beattie R. M., Nicholls S. W., Domizio P. et al. Endoscopic assessment of the colonic response to corticosteroids in children with ulcerative colitis. J. Pediatr. Gastroenterol. Nutr. 1996; 22: 373–379.
17. Mack D. R., Langton C., Markowitz J. et al. Laboratory values for children with newly diagnosed inflammatory bowel disease. Pediatrics. 2007; 119: 1113–1119.
18. Weinstein T. A., Levine M., Pettei M. J. et al. Age and family history at presentation of pediatric inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2003; 37: 609–613.
19. Henderson P., Casey A., Lawrence S. J. et al. The diagnostic accuracy of fecal calprotectin during the investigation of suspected pediatric inflammatory bowel disease. Am. J. Gastroenterol. 2012; 107: 941–949.
20. Venediktova M. M., Tsimbalova E. G., Potapov A. S., Mayanskii N. A. Voprosi diagnostiki v pediatrii — Diagnostics in pediatrics. 2011; 3 (6): 23–26.
21. Turner D., Leach S. T., Mack D. et al. Faecal calprotectin, lactoferrin, M2-pyruvate kinase and S100A12 in severe ulcerative colitis: a prospective multicentre comparison of predicting outcomes and monitoring response. Gut. 2010; 59: 1207–1212.
22. Sylvester F. A., Turner D., Draghi A., 2nd et al. Fecal osteoprotegerin may guide the introduction of second-line therapy in hospitalized children with ulcerative colitis. Inflamm. Bowel. Dis. 2011; 17: 1726–1730.
23. Harris M. S., Lichtenstein G. R. Review article: delivery and efficacy of topical 5-aminosalicylic acid (mesalazine) therapy in the treatment of ulcerative colitis. Aliment. Pharmacol. Ther. 2011; 33: 996–1009.
24. Lichtenstein G. R., Kamm M. A. Review article: 5-aminosalicylate formulations for the treatment of ulcerative colitis — methods of comparing release rates and delivery of 5-aminosalicylate to the colonic mucosa. Aliment. Pharmacol. Ther. 2008; 28: 663–673.
25. Sutherland L., Macdonald J. K. Oral 5-aminosalicylic acid for induction of remission in ulcerative colitis. Cochr. Database Syst. Rev. 2006: CD000543.
26. Sutherland L., Macdonald J. K. Oral 5-aminosalicylic acid for maintenance of remission in ulcerative colitis. Cochr. Database Syst. Rev. 2006: CD000544.
27. Odera G., Giuliani B., Santini B. et al. Topical treatment with 5-SA and hydrocortisone. Riv. Ital. Pediatr. 1986; 12: 674–678.
28. Ford A. C., Khan K. J., Sandborn W. J. et al. Efficacy of topical 5-aminosalicylates in preventing relapse of quiescent ulcerative colitis: a meta-analysis. Clin. Gastroenterol. Hepatol. 2012; 10: 513–519.
29. Kolho K. L., Raivio T., Lindahl H. et al. Fecal calprotectin remains high during glucocorticoid therapy in children with inflammatory bowel disease. Scand. J. Gastroenterol. 2006; 41: 720–725.
30. Powell-Tuck J., Bown R. L., Lennard-Jones J. E. A comparison of oral prednisolone given as single or multiple daily doses for active proctocolitis. Scand. J. Gastroenterol. 1978; 13: 833–837.
31. Uchida K., Araki T., Toiyama Y. et al. Preoperative steroid-related complications in Japanese pediatric patients with ulcerative colitis. Dis. Colon Rectum. 2006; 49: 74–79.
32. Gionchetti P., Rizzello F., Ferrieri A. et al. Rifaximin in patients with moderate or severe ulcerative colitis refractory to steroidtreatment: a double-blind, placebo-controlled trial. Dig. Dis. Sci. 1999; 44: 1220–1221.
33. Ohkusa T., Kato K., Terao S. et al. Newly developed antibiotic combination therapy for ulcerative colitis: a double-blind placebo-controlled multicenter trial. Am. J. Gastroenterol. 2010; 105: 1820–1829.
34. Timmer A., McDonald J. W., Macdonald J. K. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis. Cochr. Database Syst. Rev. 2007: CD000478.
35. Gisbert J. P., Linares P. M., McNicholl A. G. et al. Meta-analysis: the efficacy of azathioprine and mercaptopurine in ulcerative colitis. Aliment. Pharmacol. Ther. 2009; 30: 126–137.
36. Khan K. J., Dubinsky M. C., Ford A. C. et al. Efficacy of immunosuppressive therapy for inflammatory bowel disease: a systematic review and meta-analysis. Am. J. Gastroenterol. 2011; 106: 630–642.
37. Barabino A., Torrente F., Ventura A. et al. Azathioprine in paediatric inflammatory bowel disease: an Italian multicentre survey. Aliment. Pharmacol. Ther. 2002; 16: 1125–1130.
38. Kader H. A., Mascarenhas M. R., Piccoli D. A. et al. Experiences with 6-mercaptopurine and azathioprine therapy in pediatric patients with severe ulcerative colitis. J. Pediatr. Gastroenterol. Nutr. 1999; 28: 54–58.
39. Verhave M., Winter H. S., Grand R. J. Azathioprine in the treatment of children with inflammatory bowel disease. J. Pediatr. 1990; 117: 809–814.
40. Pozler O., Chladek J., Maly J. et al. Steady-state of azathioprine during initiation treatment of pediatric inflammatory bowel disease. J. Crohns Colitis. 2010; 4: 623–628.
41. Sandborn W. J. A review of immune modifier therapy for inflam matory bowel disease: azathioprine, 6-mercaptopurine, cyclosporine, and methotrexate. Am. J. Gastroenterol. 1996; 91: 423–433.
42. De Greef E., Vandenplas Y., Veereman-Wauters G. Opportunistic infections in paediatric inflammatory bowel disease patients. Arch. Dis. Child. 2011; 91: 5–7.
43. Russell R. K., Wilson M. L., Loganathan S. et al. A British Society of Paediatric Gastroenterology, Hepatology and Nutrition survey of the effectiveness and safety of adalimumab in children with inflammatory bowel disease. Aliment. Pharmacol. Ther. 2011; 33: 946–953.
44. Turner D., Griffiths A. M. Acute severe ulcerative colitis in children: a systematic review. Inflamm. Bowel. Dis. 2011; 17: 40–449.
45. Lawson M. M., Thomas A. G., Akobeng A. K. Tumour necrosis factor alpha blocking agents for induction of remission in ulcerative colitis. Cochr. Database Syst. Rev. 2006: CD005112.
46. Rutgeerts P., Sandborn W. J., Feagan B. G. et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N. Engl. J. Med. 2005; 353: 2462–2476.
47. Hyams J., Damaraju L., Blank M. et al. Induction and maintenance therapy with infliximab for children with moderate to severe ulcerative colitis. Clin. Gastroenterol. Hepatol. 2012; 10: 391–399.
48. Baranov A. A., Potapov A. S., Tsimbalova E. G. Vestnik Rossiiskoi akademii meditsinskikh nauk — Annals of the Russian Academy of Medical Sciences. 2011; 6: 36–41.
49. Hyams J. S., Lerer T., Griffiths A. et al. Outcome following infliximab therapy in children with ulcerative colitis. Am. J. Gastroenterol. 2010; 105: 1430–1436.
50. Panaccione R., Ghosh S., Middleton S. et al. Infliximab, azathioprine or infliximabюazathioprine for treatment of moderate to severe ulcerative colitis. The UC SUCCESS trial. J. Crohns Colitis. 2011; 5: 13.
51. Lichtenstein G. R., Diamond R. H., Wagner C. L. et al. Clinical trial: benefits and risks of immunomodulators and maintenance infliximab for IBD-subgroup analyses across four randomized trials. Aliment. Pharmacol. Ther. 2009; 30: 210–226.
52. Chaparro M., Guerra I., Munoz-Linares P. et al. Systematic review: antibodies and anti-TNF-alpha levels in inflammatory bowel disease. Aliment. Pharmacol. Ther. 2012; 35: 971–986.
53. Bernstein C. N., Fried M., Krabshuis J. H. et al. World Gastroenterology Organization Practice Guidelines for the diagnosis and management of IBD in 2010. Inflamm. Bowel. Dis. 2010; 16: 112–124.
54. Gonzalez-Huix F., Fernandez-Banares F., Esteve-Comas M. et al. Enteral versus parenteral nutrition as adjunct therapy in acute ulcerative colitis. Am. J. Gastroenterol. 1993; 88: 227–232.
55. McIntyre P. B., Powell-Tuck J., Wood S. R. et al. Controlled trial of bowel rest in the treatment of severe acute colitis. Gut. 1986; 27: 481–485.
56. Dickinson R. J., Ashton M. G., Axon A. T. et al. Controlled trial of intravenous hyperalimentation and total bowel rest as an adjunct to the routine therapy of acute colitis. Gastroenterology. 1980; 79: 1199–1204.
57. Barabino A., Tegaldo L., Castellano E. et al. Severe attack of ulcerative colitis in children: retrospective clinical survey. Dig. Liver Dis. 2002; 34: 44–49.
58. Bechtold S., Alberer M., Arenz T. et al. Reduced muscle mass and bone size in pediatric patients with inflammatory bowel disease. Inflamm. Bowel Dis. 2010; 16: 216–225.
59. Werkstetter K. J., Pozza S. B., Filipiak-Pittroff B. et al. Long-term development of bone geometry and muscle in pediatric inflammatory bowel disease. Am. J. Gastroenterol. 2011; 106: 988–998.
60. Gokhale R., Favus M. J., Karrison T. et al. Bone mineral density assessment in children with inflammatory bowel disease. Gastroenterology. 1998; 114: 902–911.
61. Sylvester F. A., Wyzga N., Hyams J. S. et al. Natural history of bone metabolism and bone mineral density in children with inflammatory bowel disease. Inflamm. Bowel. Dis. 2007; 13: 42–50.
62. Walther F., Fusch C., Radke M. et al. Osteoporosis in pediatric patients suffering from chronic inflammatory bowel disease with and without steroid treatment. J. Pediatr. Gastroenterol. Nutr. 2006; 43: 42–51.
63. Pappa H., Thayu M., Sylvester F. et al. Skeletal health of children and adolescents with inflammatory bowel disease. J. Pediatr. Gastroenterol. Nutr. 2011; 53: 11–25.
64. Greenley R. N., Stephens M., Doughty A. et al. Barriers to adherence among adolescents with inflammatory bowel disease. Inflamm. Bowel. Dis. 2010; 16: 36–41.
65. Hommel K. A., Denson L. A., Baldassano R. N. Oral medication adherence and disease severity in pediatric inflammatory bowel disease. Eur. J. Gastroenterol. Hepatol. 2011; 23: 250–254.
66. Hommel K. A., Baldassano R. N. Barriers to treatment adherence in pediatric inflammatory bowel disease. J. Pediatr. Psychol. 2010; 35: 1005–1010.
67. Reed-Knight B., Lewis J. D., Blount R. L. Association of disease, adolescent, and family factors with medication adherence in pediatric inflammatory bowel disease. J. Pediatr. Psychol. 2011; 36: 308–317.
68. Cassinotti A., Actis G. C., Duca P. et al. Maintenance treatment with azathioprine in ulcerative colitis: outcome and predictive factors after drug withdrawal. Am. J. Gastroenterol. 2009; 104: 2760–2767.
69. Actis G. C., Fadda M., Pellicano R. et al. The 17-year singlecenter experience with the use of azathioprine to maintain remission in ulcerative colitis. Biomed. Pharmacother. 2009; 63: 362–365.
70. Turner D., Otley A. R., Mack D. et al. Development and evaluation of a Pediatric Ulcerative Colitis Activity Index (PUCAI): a prospective multicenter study. Gastroenterology. 2007; 133: 423–432.
Источник


